题目内容
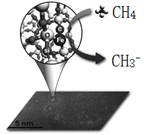
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式_________。
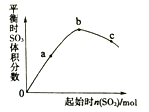
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=_______。按化学平衡移动原理,在图(a)中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。_______________________
(3)在制备C2H4时,通常存在副反应:2CH4(g)![]() C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
①在200℃时,测出乙烷的量比乙烯多的主要原因是_________________________。
②在600℃后,乙烯的体积分数减少的主要原因是__________________________。

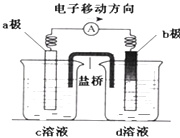
(4)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中的杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。装置中右端碳棒为_________极,左端碳棒上的电极反应为_________________________,右池中的c(NaOH):c(Na2S)______________(填“增大”、“基本不变”或“减小)。
【答案】 2CH4(g)![]() C2H4(g)+2H2(g) ΔH=+202.5 kJ/mol 0.25
C2H4(g)+2H2(g) ΔH=+202.5 kJ/mol 0.25 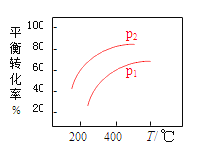 在200℃时,乙烷的生成速率比乙烯的快 在600℃后,乙烯开始分解为碳和氢气 阳 2H2O+2e-=2OH-+H2↑或2H++2e-=H2↑ 基本不变
在200℃时,乙烷的生成速率比乙烯的快 在600℃后,乙烯开始分解为碳和氢气 阳 2H2O+2e-=2OH-+H2↑或2H++2e-=H2↑ 基本不变
【解析】(1)根据燃烧热数据表可得:①H2(g)+ ![]() O2(g)=H2O(l) ΔH1=-285.8kJ/mol;②CH4(g) + 2O2(g)=CO2(g)+2H2O(l) ΔH2=-890. 3kJ/mol; ③C2H4(g) + 3O2(g)=2CO2(g)+2H2O(l) ΔH3=-1411.0kJ/mol;根据盖斯定律,由②×2-③-①×2得反应2CH4(g)
O2(g)=H2O(l) ΔH1=-285.8kJ/mol;②CH4(g) + 2O2(g)=CO2(g)+2H2O(l) ΔH2=-890. 3kJ/mol; ③C2H4(g) + 3O2(g)=2CO2(g)+2H2O(l) ΔH3=-1411.0kJ/mol;根据盖斯定律,由②×2-③-①×2得反应2CH4(g)![]() C2H4(g)+2H2(g) ΔH=ΔH2×2-ΔH3-ΔH1×2=-890. 3kJ/mol×2-(-1411.0kJ/mol)-(-285.8kJ/mol)×2=+202.2 kJ/mol;(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生反应2CH4(g)
C2H4(g)+2H2(g) ΔH=ΔH2×2-ΔH3-ΔH1×2=-890. 3kJ/mol×2-(-1411.0kJ/mol)-(-285.8kJ/mol)×2=+202.2 kJ/mol;(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生反应2CH4(g)![]() C2H4(g)+2H2(g),测得平衡混和气体中C2H4的体积分数为20.0%。设甲烷的转化率为x,则:
C2H4(g)+2H2(g),测得平衡混和气体中C2H4的体积分数为20.0%。设甲烷的转化率为x,则:
2CH4(g)![]() C2H4(g)+2H2(g)
C2H4(g)+2H2(g)
起始浓度(mol/L) 1 0 0
改变浓度(mol/L) x x/2 x
平衡浓度(mol/L) 1-x x/2 x
相同条件下,气体的物质的量之比等于体积之比,则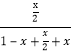 =20.0%,解得x=0.5mol/L,K=
=20.0%,解得x=0.5mol/L,K=![]() =0.25;按化学平衡移动原理,该反应正反应为气体体积增大的吸热反应,升高温度平衡正向移动,平衡转化率增大,增大压强,平衡逆向移动,平衡转化率减小,对应图中曲线为(p1>p2):
=0.25;按化学平衡移动原理,该反应正反应为气体体积增大的吸热反应,升高温度平衡正向移动,平衡转化率增大,增大压强,平衡逆向移动,平衡转化率减小,对应图中曲线为(p1>p2): ;(3)①根据图中曲线可知,在200℃时,乙烷的生成速率比乙烯的快,测出乙烷的量比乙烯多;②在600℃后,乙烯开始分解为碳和氢气,乙烯的体积分数减少;(4)装置中右端硫离子失电子转化为硫单质,硫元素被还原,则右端碳棒为阳极,左端碳棒为阴极产生氢气,阴极的电极反应为:2H2O+2e-=2OH-+H2↑;因接通电源,继续通入含杂质的甲烷气,并控制好通气速率。故右池中的c(NaOH):c(Na2S)基本不变。
;(3)①根据图中曲线可知,在200℃时,乙烷的生成速率比乙烯的快,测出乙烷的量比乙烯多;②在600℃后,乙烯开始分解为碳和氢气,乙烯的体积分数减少;(4)装置中右端硫离子失电子转化为硫单质,硫元素被还原,则右端碳棒为阳极,左端碳棒为阴极产生氢气,阴极的电极反应为:2H2O+2e-=2OH-+H2↑;因接通电源,继续通入含杂质的甲烷气,并控制好通气速率。故右池中的c(NaOH):c(Na2S)基本不变。

 名校课堂系列答案
名校课堂系列答案【题目】类比推理是重要的学科思想,下列根据已知进行推理正确的是( )
选项 | 已知 | 类比推理 |
A |
|
|
B |
|
|
C | 常温下,浓硝酸使铁钝化 | 浓硝酸与铜不反应 |
D |
| 过量 |
A. A B. B C. C D. D