��Ŀ����
����Ŀ������������Ԫ��X��Y��R��M��ԭ������������������ֻ��R���ڽ���Ԫ�أ���X��Y��R�����һ�ֻ�����Q����298Kʱ��0.1mol��L��1 Q��Һ��AG(���)��lg![]() ����12����X��M��ɵĻ�����XM��ǿ����ʡ�����˵����ȷ����
����12����X��M��ɵĻ�����XM��ǿ����ʡ�����˵����ȷ����
A. Y��R��M����Ԫ���γɵļ����Ӱ뾶��r(M)>r(R)>r(Y)
B. M���������Ӧ��ˮ����һ����ǿ��
C. R�ֱ���X��Y��M��ɵĶ�Ԫ�������ж��������Ӽ�
D. ������RYX��RMY��������ˮ�ĵ���
���𰸡�C
������������������Ԫ��X��Y��R��M��ԭ������������������ֻ��R���ڽ���Ԫ�أ���X��Y��R�����һ�ֻ�����Q��298Kʱ��0.1molL-1Q��Һ��AG(���)=lg =-12����c(H+)=c(OH-)��10-12�����ˮ�����ӻ���֪c(OH-)c(OH-)��10-12=10-14����c(OH-)=0.1mol/L��˵��Q��ҺΪһԪǿ���QΪNaOH������ԭ��������С��֪XΪH��YΪO��RΪNaԪ�أ���X��M��ɵĻ�����XM��ǿ����ʣ�M��ԭ����������Na����MΪClԪ�ء�A��RΪNa��YΪO��MΪClԪ�أ����ӵĵ��Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ���ͬʱ�����ӵĺ˵����Խ�����Ӱ뾶ԽС��������Ӱ뾶��M��Y��R����A������B��MΪClԪ�أ������������Ӧˮ����Ϊǿ�ᣬû��ָ����ۣ����Ӧ�һ��Ϊǿ�ᣬ������ᣬ��B����C��R(Na)Ϊ���ý������ֱ���X(H)��Y(O)��M(Cl)��ɵĶ�Ԫ�������ж��������Ӽ�����C��ȷ��D��������RYXΪNaOH��RMYΪNaClO����������������ˮ�ĵ��룬�����������ܹ��ٽ�ˮ�ĵ��룬��D����ѡC��
=-12����c(H+)=c(OH-)��10-12�����ˮ�����ӻ���֪c(OH-)c(OH-)��10-12=10-14����c(OH-)=0.1mol/L��˵��Q��ҺΪһԪǿ���QΪNaOH������ԭ��������С��֪XΪH��YΪO��RΪNaԪ�أ���X��M��ɵĻ�����XM��ǿ����ʣ�M��ԭ����������Na����MΪClԪ�ء�A��RΪNa��YΪO��MΪClԪ�أ����ӵĵ��Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ���ͬʱ�����ӵĺ˵����Խ�����Ӱ뾶ԽС��������Ӱ뾶��M��Y��R����A������B��MΪClԪ�أ������������Ӧˮ����Ϊǿ�ᣬû��ָ����ۣ����Ӧ�һ��Ϊǿ�ᣬ������ᣬ��B����C��R(Na)Ϊ���ý������ֱ���X(H)��Y(O)��M(Cl)��ɵĶ�Ԫ�������ж��������Ӽ�����C��ȷ��D��������RYXΪNaOH��RMYΪNaClO����������������ˮ�ĵ��룬�����������ܹ��ٽ�ˮ�ĵ��룬��D����ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���п�Ժһ�����³ɹ�ʵ���˼����Ч������ϩ�������ڴ����������⣬�������о����ɻ�ż����Ӧ������ϩ����ͼ��ʾ��
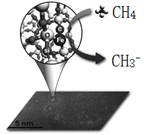
���� | ȼ������kJ/mol�� |
���� | 285��8 |
���� | 890��3 |
��ϩ | 1411��5 |
��1����֪������ʵ�ȼ�������ϱ���д�������Ʊ���ϩ���Ȼ�ѧ����ʽ_________��
��2����400��ʱ����1L�ĺ��ݷ�Ӧ���г���1molCH4������������Ӧ�����ƽ����������C2H4���������Ϊ20.0 %�����ڸ��¶��£���ƽ�ⳣ��K=_______������ѧƽ���ƶ�ԭ������ͼ(a)�л����÷�Ӧ��ƽ��ת�������¶ȼ�ѹǿ(p1>p2)�Ĺ�ϵ���ߡ�_______________________
��3�����Ʊ�C2H4ʱ��ͨ�����ڸ���Ӧ��2CH4(g)![]() C2H6(g)+H2(g)���ڳ����£������Ϊ1L�ĺ��ݷ�Ӧ���г���1molCH4��Ȼ�������¶ȣ��õ�ͼ(b)��
C2H6(g)+H2(g)���ڳ����£������Ϊ1L�ĺ��ݷ�Ӧ���г���1molCH4��Ȼ�������¶ȣ��õ�ͼ(b)��
����200��ʱ����������������ϩ�����Ҫԭ����_________________________��
����600������ϩ������������ٵ���Ҫԭ����__________________________��

��4����ҵ�ϳ����ó���Ч�ʸߵ�����-������Ϸ�����ȥ��Ȼ���е���������H2S����ת��Ϊ�ɻ������õĵ�������װ������ͼ��ʾ��

ͨ��ǰ����ͨ��һ��ʱ�京H2S�ļ�������ʹ����NaOH����H2Sת��ΪNa2S���ٽ�ͨ��Դ������ͨ�뺬���ʵļ������������ƺ�ͨ�����ʡ�װ�����Ҷ�̼��Ϊ_________�������̼���ϵĵ缫��ӦΪ_________________________���ҳ��е�c(NaOH)��c(Na2S)______________(������������������������������С)��
����Ŀ������ѡ�õ�������ҩƷ�ܴﵽʵ��Ŀ���ǣ�������
A | B | C | D |
|
| ����NaHSO3��Һ | |
����Ȳ�ķ���װ�� | ����ʱ�Ľ���װ�� | ��ȥSO2�е�����HCl | ȷ��ȡһ�����K2Cr2O7����Һ |
A.A
B.B
C.C
D.D


