题目内容
【题目】漂白粉的有效成分是( )
A.氯化钙
B.次氯酸钙
C.氯化钙与次氯酸钙
D.次氯酸
【答案】B
【解析】漂白粉的成分是氯化钙和次氯酸钙,有效成分是次氯酸钙,故选项C正确。氯气与石灰乳反应生成漂白粉,有效成分是次氯酸钙。

【题目】如图是立方烷(cunane)的球棍模型,下列有关说法不正确的是( ) 
A.其一氯代物只有一种
B.其二氯代物有三种同分异构体
C.常温下为气体
D.它与苯乙烯(C6H5﹣CH═CH2)互为同分异构体
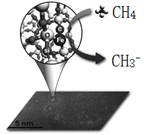
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式_________。
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=_______。按化学平衡移动原理,在图(a)中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。_______________________
(3)在制备C2H4时,通常存在副反应:2CH4(g)![]() C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
①在200℃时,测出乙烷的量比乙烯多的主要原因是_________________________。
②在600℃后,乙烯的体积分数减少的主要原因是__________________________。

(4)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中的杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。装置中右端碳棒为_________极,左端碳棒上的电极反应为_________________________,右池中的c(NaOH):c(Na2S)______________(填“增大”、“基本不变”或“减小)。