题目内容
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务,回答有关问题:
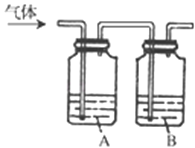
(1)在一定条件下,2H2O==2H2↑+O2↑,下图能正确表示该反应中能量变化的是________(用A、B表示)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:则生成1mol水热量变化为________kJ。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
(2)在生产和生活中经常遇到化学能与电能的相互转化,银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。在装置中Ag2O作_______极(填正或负)溶液中的K+向_____电极移动(填“Zn”或“Ag2O”);Ag2O电极发生______(还原或氧化反应),电极反应式为_____________________。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为1L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
【答案】B 242 正极 Ag2O 还原 Ag2O+2e-+H2O=2Ag+2OH- 0.4mol/(L·min) 1 40% 小于
【解析】
(1)在一定条件下,2H2O==2H2↑+O2↑,属于分解反应,为吸热反应,反应物的总能量小于生成物的总能量,能正确表示该反应中能量变化的是B;根据2H2+O2=2H2O反应,断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成2mol水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即 H2在氧气中燃烧生成1mol水放出的热量为242kJ;答案为B,242。
(2)根据银锌电池反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,Zn由0价失电子变为+2价,Ag2O中的银由+1价得电子变0价,就可判断活泼金属Zn为负极,Ag2O是正极,原电池中阳离子向正极移动,所以K+朝正极即Ag2O移动,由于Ag2O是正极,发生得电子的还原反应,电极反应为Ag2O+H2O+2e-=2Ag+2OH-;答案为正极,Ag2O,还原,Ag2O+H2O+2e-=2Ag+2OH-。
(3)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,参加反应的A的物质的量为3mol-1.8mol=1.2mol,由方程式可知,参加反应的B为1.2mol×![]() =0.4mol,则1min内,B的平均反应速率为
=0.4mol,则1min内,B的平均反应速率为 =0.4mol/(L.min);生成的C为0.4mol/L×1L=0.4mol,故1.2mol:0.4mol=3:x,解得x=1;B的转化率=
=0.4mol/(L.min);生成的C为0.4mol/L×1L=0.4mol,故1.2mol:0.4mol=3:x,解得x=1;B的转化率= ![]() ×100%=
×100%=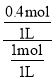 ×100%=40%;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;答案为0.4mol/(Lmin), 1,40%,小于。
×100%=40%;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;答案为0.4mol/(Lmin), 1,40%,小于。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案