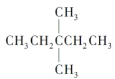
题目内容
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。

已知:氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
(1)B中加入的干燥剂是____(填序号)。
①浓硫酸 ②无水氯化钙 ③碱石灰
(2)能证明氨与氧化铜反应的现象是C中________。
(3)D中有无色液体生成。设计实验检验D中无色液体的成分:__________
【答案】③ 黑色粉末变红 取少量无水硫酸铜粉末放入D中,现象为白色变蓝色,则证明有水生成
【解析】
A中装有熟石灰和NH4Cl,加热时产生氨气,经过碱石灰干燥,进入C中,和C中的氧化铜发生反应,生成氮气和铜,根据质量守恒,还应该有水生成。冰水混合物是用来冷却生成的水蒸气的,最后氮气用排水法收集在试管E中。
(1)U形干燥管只能装固体干燥剂,浓硫酸是液体干燥剂且浓硫酸也能与NH3反应,无水氯化钙能与NH3反应形成配合物。故选择③碱石灰;
(2)黑色的氧化铜生成了红色的铜单质,所以现象为黑色粉末变红;
(3)因为已知NH3和CuO反应生成了Cu和N2,根据质量守恒,还会有H2O生成,则D中无色液体为水,检验水一般用无水硫酸铜。故答案为:取少量无水硫酸铜粉末放入D中,现象为白色变蓝色,则证明有水生成。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务,回答有关问题:
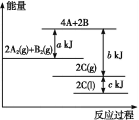
(1)在一定条件下,2H2O==2H2↑+O2↑,下图能正确表示该反应中能量变化的是________(用A、B表示)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:则生成1mol水热量变化为________kJ。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
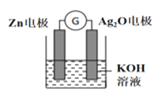
(2)在生产和生活中经常遇到化学能与电能的相互转化,银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。在装置中Ag2O作_______极(填正或负)溶液中的K+向_____电极移动(填“Zn”或“Ag2O”);Ag2O电极发生______(还原或氧化反应),电极反应式为_____________________。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为1L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。