题目内容
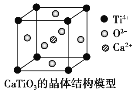
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示
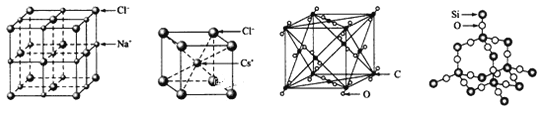
(1) 在NaCl的晶胞中,与Na+最近且等距的Na+有_____个,在NaCl的晶胞中有Na+_____个,Cl-____个
(2)在CsCl的晶胞中,Cs+与Cl-通过_________结合在一起。
(3) 1mol二氧化硅中有______mol硅氧键。
(4)设二氧化碳的晶胞密度为a g/cm3,写出二氧化碳的晶胞参数的表达式为____n m (用含NA的代数式表示)
【答案】12 4 4 离子键 4 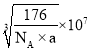
【解析】
(1)氯化钠晶体中氯离子位于定点和面心,钠离子位于边和体心;
(2)阴、阳离子之间的静电作用为离子键;
(3)二氧化硅是原子晶体,每个硅原子与4个氧原子形成硅氧键;
(4)晶胞中CO2分子数目为8![]() +6
+6![]() =4,晶胞的质量为
=4,晶胞的质量为![]() g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度
g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度![]() 。
。
(1)晶胞中位于体心的钠离子和位于边上Na+的短离最近,则最近且等距的Na+共有12个Na+;晶胞中Na+的个数为1+12![]() =4,Na+的个数为8
=4,Na+的个数为8![]() +6
+6![]() =4;
=4;
(2)在CsCl的晶胞中,Cs+与Cl-通过离子键结合在一起;
(3)二氧化硅是原子晶体,每个硅原子与4个氧原子形成硅氧键,则1mol二氧化硅中有4mol硅氧键;
(4)晶胞中CO2分子数目为8![]() +6
+6![]() =4,晶胞的质量为
=4,晶胞的质量为![]() g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度
g,晶胞的体积为(anm)3=(a×10-7cm)3,晶胞的密度![]() ,则a=
,则a= nm=
nm=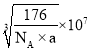 nm。
nm。

练习册系列答案
相关题目