题目内容
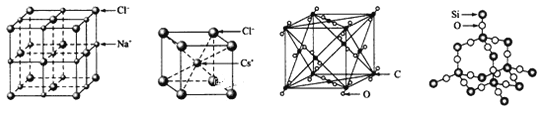
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶胞结构如图所示。下列说法中错误的是( )
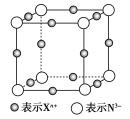
A.晶体中每个Xn+周围有2个等距离且最近的N3-
B.该晶体中阳离子与阴离子的个数比为3︰1
C.n=1
D.Xn+的核外电子数为18
【答案】D
【解析】
根据均摊法,该晶胞中Xn+的个数为![]() =3,N3-的个数为
=3,N3-的个数为![]() =1,所以该晶体的化学式为X3N,根据化合价的代数和为0知n=+1,X+中所有电子正好充满K、L、M三个电子层,则X原子核外电子数=2+8+18+1=29,为Cu元素。
=1,所以该晶体的化学式为X3N,根据化合价的代数和为0知n=+1,X+中所有电子正好充满K、L、M三个电子层,则X原子核外电子数=2+8+18+1=29,为Cu元素。
A.X+位于棱心,晶胞顶点的N3+距离其最近,所以晶体中每个Xn+周围有2个等距离且最近的N3-,故A正确;
B.根据均摊法,该晶胞中Xn+的个数为![]() =3,N3-的个数为
=3,N3-的个数为![]() =1,故B正确;
=1,故B正确;
C.N3-、Xn+个数之比为1:3,根据化合物中化合价的代数和为0判断n=1,故C正确;
D.Xn+的核外电子数=2+8+18=28,故D错误;
故答案为D。

练习册系列答案
相关题目
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D