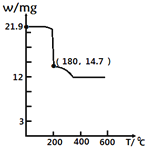
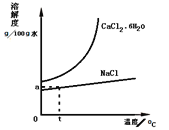
��Ŀ����
����Ŀ��(1)̼ԭ��2p�Dz��ϵ�2�����Ӳ���ͬ�ķ�����____��ѡ����ţ���
a������ b����������״ c����������չ���� d������״̬
14N ԭ����12Cԭ�ӱȣ��������������������࣬��ԭ�Ӱ뾶ȴ��С�������__________________��
(2)��(Be)�����������ơ�
�����¶��뼰�仯������ƶϿ϶�����ȷ����______��ѡ����ţ���
a�������Ũ�����жۻ� b���Ȼ������ᷢ����������
c���������Ӳ���� d������۵����þ
��д��BeCl2��Һ��Na2BeO2��Һ��Ϻ�Ӧ�����ӷ���ʽ____________________________��
(3)��BeCl2��Һ�������ɺ����ȣ���ʹ�����ڣ���ֱ�����⣬�ɵõ��������һ�ֵ������壬�������Ļ�ѧʽΪ_______��
(4)������(AlN)�㷺Ӧ���ڼ��ɵ�·�����Ʊ�ԭ���ǽ���������̼�ۻ�Ͼ��ȣ��ڳ��������ĵ������м�����1750�棬�������·�Ӧ��
2Al2O3(s)![]() 4Al(g)+3O2(g) ��
4Al(g)+3O2(g) ��
2C(s)+ O2(g)![]() 2CO(g) ��
2CO(g) ��
2Al(g)+N2(g)![]() 2AlN(s) ��
2AlN(s) ��
�Է�����Ӧ�ڶ��Ʊ�AlN������______________________________________________��
���𰸡�c ��ԭ���У����Ӻ�����ռ���������С�����Ӳ�����ͬʱ���˵����Խ�˶������ӵ�����Խ��ԭ�Ӱ뾶ԽС d Be2++ BeO22-+2H2O ![]() 2Be(OH)2�� O2 ����O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN
2Be(OH)2�� O2 ����O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN
��������
(1)̼ԭ��2p�Dz��ϵ�2�������Ų��ڲ�ͬ�Ĺ���ϣ���������״̬��ͬ��
14N ԭ����12Cԭ�ӱȣ��������������������࣬��ԭ�Ӱ뾶ȴ��С����ԭ�Ӻ˶������ӵ�������������
(2)��a��������Ũ�����жۻ�
b���Ȼ�������ᷢ����������
c����������Ӳ����
d�������۵����þ
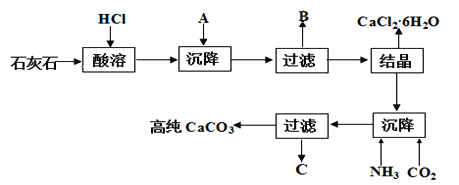
��BeCl2��Һ��Na2BeO2��Һ��Ϻ���˫ˮ�ⷴӦ������Be(OH)2������
(3)��BeCl2��Һ�������ɺ����ȣ����õ�BeO���ɴ˿ɵ����ڵ�����õ�������Ļ�ѧʽ��
(4)�Ʊ�AlN���Ʊ�Al���ǿ��淴Ӧ���ӷ�Ӧ�ڶԷ�Ӧ�٢۵Ĵٽ����ý��з�����
(1)̼ԭ��2p�Dz��ϵ�2�������Ų��ڲ�ͬ�Ĺ���ϣ���������״̬��ͬ��������չ����ͬ����ѡc����Ϊ��c��
14N ԭ����12Cԭ�ӱȣ��������������������࣬��ԭ�Ӱ뾶ȴ��С����������ԭ���У����Ӻ�����ռ���������С�����Ӳ�����ͬʱ���˵����Խ�˶������ӵ�����Խ��ԭ�Ӱ뾶ԽС����Ϊ����ԭ���У����Ӻ�����ռ���������С�����Ӳ�����ͬʱ���˵����Խ�˶������ӵ�����Խ��ԭ�Ӱ뾶ԽС��
(2)��a��������Ũ�����жۻ���������Ũ������Ҳ���ܶۻ���a������ȷ��
b���Ȼ�������ᷢ�������������Ȼ������Ҳ���ܷ���������b������ȷ��
c����������Ӳ���ۣ�������Ҳ���ܼ�Ӳ���ۣ�c������ȷ��
d�������۵����þ������۵�Ҳ���ܸ�����(Be2+�뾶��Mg2+С�����������ͬ���γɽ������壬����������)��d�϶�����ȷ��
�Ӷ��ó������뼰�仯������ƶϿ϶�����ȷ����d����Ϊ��d��
��BeCl2��Һ��Na2BeO2��Һ��Ϻ���˫ˮ�ⷴӦ������Be(OH)2��������Ӧ�����ӷ���ʽΪ��Be2++ BeO22-+2H2O ![]() 2Be(OH)2������Ϊ��Be2++ BeO22-+2H2O
2Be(OH)2��������Be2++ BeO22-+2H2O ![]() 2Be(OH)2����
2Be(OH)2����
(3)��BeCl2��Һ�������ɺ����ȣ����õ�BeO���ɴ˿ɵ����ڵ�⣬����Be�����������õ�������Ļ�ѧʽΪO2����Ϊ��O2��
(4)�Ʊ�AlN���Ʊ�Al���ǿ��淴Ӧ����Ӧ�����ķ�Ӧ�����ɵ�O2���Ӷ������ڢ٢۷�Ӧ�Ľ��У��Ӷ��ó����Ʊ�AlN������������O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN����Ϊ������O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN��

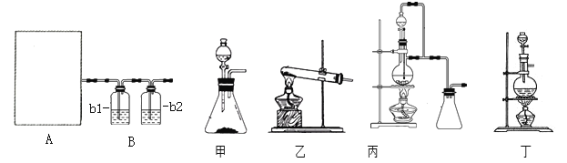
����Ŀ����ij��Br����ˮ����ȡBr2�Ĺ��̰��������ˡ���������ȡ����ѡ�������ȡ����������Ȳ��衣��֪��
���� | Br2 | CCl4 | ��ʮ���� |
�ܶ�/g��cm-3 | 3.119 | 1.595 | 0.753 |
�е�/�� | 58.76 | 76.8 | 215~217 |
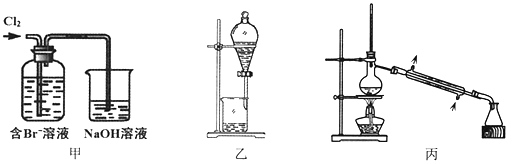
����˵������ȷ����
A. ��װ����Br�������ķ�ӦΪ��2Br-+ Cl2 = Br2 + 2Cl-
B. ��װ����NaOH��Һÿ����0.1mol Cl2��ת��0.1mol e��
C. ����װ�ý�����ȡ���ܽ�Br2���л������²�
D. �ñ�װ�ý����������ռ�������Br2