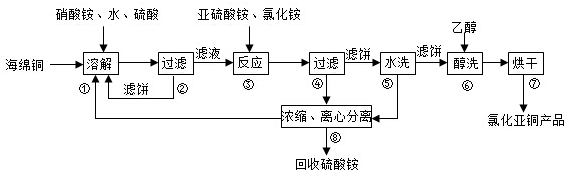
题目内容
9.食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的.已知:氧化性:IO3->Fe3+>I2还原性:S2O32->I-
反应式:KI+I2?KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+).用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色.
①该红色物质是Fe(SCN)3 (用化学式表示);CCl4中显示紫红色的物质是
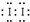 (用电子式表示).
(用电子式表示).②第二份试液中加入足量KI固体后,反应的离子方程式为IO3-+5I-+6H+═3I2+3H2O;2Fe3++2I-═2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式:4KI+O2+2H2O═2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3?H2O.该物质作为食盐加碘剂是否合适?否 (填“是”或“否”),并说明理由:KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华;.
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是AC.
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+:取少量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+..
分析 (1)①给出的离子中,只有Fe3+遇KSCN溶液显红色,Fe3+与KI发生氧化还原反应生成的碘单质,易溶于有机溶剂,且碘在四氯化碳中显紫色;
②具有氧化性的离子为IO3-、Fe3+,具有还原性的离子为I-,利用氧化还原反应来分析;
(2)根据KI具有还原性及氧化还原反应、KI3在常温下不稳定性来分析;
(3)根据提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化来分析;
(4)将亚铁离子转化为铁离子,再利用铁离子遇KSCN溶液变红色来检验.
解答 解:(1)某加碘盐可能含有KIO3、KI、Mg2+、Fe3+,用蒸馏水溶解,并加稀盐酸酸化后将溶液分为3份.从第一份试液中滴加KSCN溶液后显红色,可知该加碘盐中含有Fe3+,反应:Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3呈血红色;从第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色,可知有碘生成.这是因为由于“氧化性:IO3->Fe3+>I2”,加足量KI后,IO3-和Fe3+均能将I-氧化成I2,由此也可以知道该加碘盐添加KIO3;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.由此可知该加碘盐中不含KI.
①该加碘盐溶液中加KSCN溶液显红色的物质是Fe(SCN)3,CCl4中显紫红色的物质是I2,电子式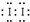 ,故答案为:Fe(SCN)3;
,故答案为:Fe(SCN)3;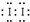 ;
;
②第二份试液中加入足量KI固体后,反应的离子方程式为IO3-+5I-+6H+═3I2+3H2O、2Fe3++2I-═2Fe2++I2,故答案为:IO3-+5I-+6H+═3I2+3H2O;2Fe3++2I-═2Fe2++I2;
(2)KI作为加碘剂的食盐在保存过程中,KI会被空气中氧气氧化,KI在潮湿空气中氧化的反应化学方程式为:4KI+O2+2H2O═2I2+4KOH,根据题目告知,KI3•H2O是在低温条件下,由I2溶于KI溶液可制得.再由题给的信息:“KI+I2?KI3”,可知KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3•H2O作为食盐加碘剂是不合适的,故答案为:4KI+O2+2H2O═2I2+4KOH;否;KI3受热(或潮湿)条件下产生KI和I2,KI被氧气氧化,I2易升华;
(3)提高加碘盐(添加KI)的稳定性,主要是防止I- 被氧化,根据题给信息“还原性:S2O32->I-”和氧化还原反应的强弱规律,可以选Na2S2O3作稳定剂;又由题给信息
“3I2+6OH-═IO3-+5I-+3H2O”,可知I2与OH-会发生反应生成IO3-和5I-,而Na2CO3水解呈碱性,因而也可以用Na2CO3作稳定剂,防止加碘盐(添加KI)在潮湿环境下被氧气氧化.至于AlCl3,水解后呈酸性,且还原性I->Cl-,所不能作稳定剂;NaNO2当遇强还原性物质时能表现出氧化性,则NaNO2与KI能发生氧化还原反应为
2NO2-+2I-+4H+=2NO↑+I2+2H2O,所以不能作稳定剂,故答案为:AC;
(4)实际上就是设计实验方案,检验Fe2+.首先可取少量该加碘盐溶于蒸馏水中,然后用盐酸酸化后,滴加适量氧化剂(如:氯水、过氧化氢等),使溶液中Fe2+转化为Fe3+,再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+,
故答案为:取少量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+.
点评 本题以日常生活中熟悉的食盐和加碘盐中碘的损失原因为素材,要求通过实验,检验加碘盐中所含有的成分物质,探究保存过程中由于空气中氧气的作用容易引起碘损失的反应、探讨KI3•H2O作为食盐加碘剂是否合适、以及提高加碘盐(添加KI)的稳定性可添加的稳定剂,设计实验方案检验选用KI作为加碘剂的加碘盐中的Fe2+等,从而考查物质的检验、氧化还原反应和氧化还原反应方程式、离子反应和离子反应方程式、电子式、以及实验方案的设计等化学基础知识和基本技能.题目难度中等

| A. | 该溶液c(H+)≥0.1 mol/L | |
| B. | 把该溶液稀释成1 L后,pH≥2 | |
| C. | 把该溶液稀释成1 L后,pH≤2 | |
| D. | 中和此溶液需0.1mol/L的NaOH体积≥100mL |
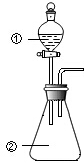 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |