题目内容
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
反应ZnS(s) + C(s) + 2O2(g)=Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
(2)反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H﹤0
CO(NH2)2(s)+H2O(g)△H﹤0
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
若想提高氨气的转化率,可以采取的措施有 (写出两条)
(3)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
①700℃~980℃时发生反应中生成物质二氧化硫、ZnO和氧气,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,则这段时间二氧化硫的生成速率为 。
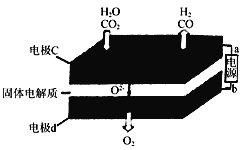
② 硫酸锌分解生成的SO2经下图中的循环可得到H2SO4。循环中电解过程阳极反应式是 。


【答案】(1)-377.5 (2)b d ,增大压强,适当降低温度等合理答案均可
(3)0.03mol/(L·min), Mn2+-2e-+2H2O=MnO2+4H+
【解析】
试题分析:(1)已知:2ZnS(s) + 3O2(g)=2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1①
H1=-930 kJ·mol-1①
2C(s) + O2(g)=2CO(g) ![]() H2=-221 kJ·mol-1②
H2=-221 kJ·mol-1②
ZnO(s) + CO(g)=Zn(g) + CO2(g) ![]() H3=+198 kJ·mol-1③
H3=+198 kJ·mol-1③
根据盖斯定律可知将方程式(①+②)/2+③得ZnS(s) + C(s) + 2O2(g)=Zn(g) + CO2(g) + SO2(g)的△H=(930221)kJ/mol÷+198kJ/mol=-377.5kJ/mol;
(2)a.CO2与H2O(g)浓度相等,正逆反应速率不一定相等,所以不一定达到平衡状态,a错误;b.该反应前后气体物质的量减少,当容器中气体的压强不再改变时正逆反应速率相等,反应达到平衡状态,b正确;c.当v(NH3)正=2v(H2O)逆时该反应达到平衡状态,所以当2v(NH3)正 = v(H2O)逆时该反应没有达到平衡状态,c错误;d.反应前后混合气体的密度改变,所以当容器中混合气体的密度不再改变时该反应达到平衡状态,d正确;答案选bd;由于正反应是体积减小的放热反应,则若想提高氨气的转化率,可以采取的措施有增大压强,适当降低温度等。
(3)①反应的方程式为2ZnSO4=2ZnO+2SO2↑+O2↑,10min时,测得生成的氧气的物质的量为0.3mol,则这段时间内生成二氧化硫是0.6mol,浓度是0.3mol/L,则二氧化硫的生成速率为0.3mol/L÷10min=0.03mol/(L·min);
②电解硫酸锰时,生成二氧化锰和硫酸,阳极上失电子发生氧化反应,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+。