题目内容
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的![]() 倍,试回答:
倍,试回答:
(1)X元素的名称: ,Y元素在元素周期表中的位置 ,Z元素的原子结构示意图 .
(2)Y2X对应水化物的电子式 ,其中存在的化学键有 .
(3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因 .
【答案】(1) 氧;第三周期IA族;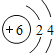
(2)![]() ;离子键、共价键
;离子键、共价键
(3)H2O分子之间存在氢键
【解析】试题分析:Z原子有2个电子层,最外层电子数是核外电子数的![]() 倍,令最外层电子数为a,则
倍,令最外层电子数为a,则![]() (2+a)=a,解得a=4,所以Z为C元素;设X原子的质子数为x,Y原子的质子数为y,三种元素原子的质子总数为25,则有6+x+y=25,Z和Y的原子序数之和比X的原子序数2倍还多1,则有6+y=2x+1,联立方程解得:x=8,y=11,即X为氧元素,Y为钠元素。
(2+a)=a,解得a=4,所以Z为C元素;设X原子的质子数为x,Y原子的质子数为y,三种元素原子的质子总数为25,则有6+x+y=25,Z和Y的原子序数之和比X的原子序数2倍还多1,则有6+y=2x+1,联立方程解得:x=8,y=11,即X为氧元素,Y为钠元素。
(1)由上述分析可知,X为氧元素,Y为钠元素,处于周期表中第三周期IA族,Z为碳元素,原子结构示意图为: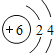 。
。
故答案为:氧;第三周期IA族;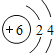 ;
;
(2)Y2X为Na2O,对应水化物为NaOH,其电子式为:![]() ,含有离子键、共价键。
,含有离子键、共价键。
故答案为:![]() ;离子键、共价键;
;离子键、共价键;
(3)H2O分子之间存在氢键,比同主族的氢化物的熔沸点明显偏高。
故答案为:H2O分子之间存在氢键。

练习册系列答案
相关题目