题目内容
【题目】已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物(如Na2Sn)。回答下列问题:
Ⅰ.在浓Na2S溶液中滴入少量氯水,经振荡,未发现沉淀物生成,其原因是(用离子方程式表示)___________________________________________________。
Ⅱ.浓硫酸具有氧化性,不同浓度的硫酸氧化性不同。为了探究浓度对硫酸氧化性的影响,某学习小组进行了如下探究:称取一定量无锈铁钉(碳素钢)放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。为了测定气体Y中SO2的含量,设计如下三种方案:
方案①:取V mL(标准状况)气体Y通入足量氯水中,然后加入足量BaCl2溶液,经“适当操作”后得干燥固体m g。
方案②:向200.0 mL 0.200 mol/L酸性高锰酸钾溶液中缓慢通入2.24 L(标准状况)气体Y,之后取出20.00 ml溶液转入锥形瓶中加适量水稀释,用浓度为0.100 mol/L的KHC2O4标准液进行滴定,最终消耗标准液10.00ml。
(1)方案①中“适当操作”是指 (填操作名称);检验所得固体是否洗涤干净的操作为 ;
(2)已知室温下,0.1mol/L 的KHC2O4溶液中,c(C2O42- )>c(H2C2O4)。在方案②中,滴定操作过程中标准液应装在 (填仪器名称);滴定至终点的现象为 ;
(3)根据方案②计算气体Y中SO2的物质的量分数为 ;
Ⅲ.分析上述实验中SO2体积分数的结果,某同学认为气体Y中还可能含有少量的H2和CO2。为此设计了下列探究实验装置检验其中的杂质气体(夹持装置已略去)。
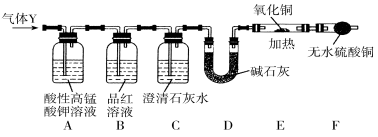
(1)仪器D的名称是 ;B中试剂的作用是 ;
(2)简述确认气体Y中含有CO2的实验现象:________________________________。
(3)根据“F干燥管中无水硫酸铜是否变蓝色”确认气体Y中是否有氢气,你认为是否合理?______(填“合理”或“不合理”),简述理由:___________________________________。
【答案】Ⅰ.nS2-+(n-1)Cl2=(2)n-2)Cl-+Sn2- 或[ S2-+Cl2=S↓+2Cl-;S2-+(n-1)S = Sn2- ];
Ⅱ.(1)过滤、洗涤、干燥; 取最后一次洗液少许于试管中,滴加硝酸酸化的硝酸银溶液,若无白色沉淀,证明沉淀已洗净(或其它合理答案);
(2))酸式滴定管;最后一滴标准液滴入时,溶液变为无色且半分钟内不恢复;
(3)90%
Ⅲ.(1)U型管; 检验SO2是否除尽;(2))B中品红不褪色,C中浑浊;
(3)不合理;空气中的水蒸气进入F中,也可以使无水硫酸铜变蓝;
【解析】
试题分析:
Ⅰ.在浓Na2S溶液中滴入少量氯水时,Cl2先将S2-氧化为单质硫:S2-+Cl2===2Cl-+S↓,由于S2-大量剩余,所以接下来会发生反应:(n-1)S+S2-===Sn2- 。两式相加可得。
Ⅱ.(1)碳素钢中的碳和铁在加热条件下都会和浓硫酸反应产生CO2和SO2,SO2通入足量氯水中氧化后再与足量BaCl2溶液反应得BaSO4沉淀,故后续操作为过滤、洗涤、干燥得干燥固体。检验所得固体是否洗涤干净,可根据滤液中是否含有Cl-来证明,其操作为:取最后一次洗液少许于试管中,滴加硝酸酸化的硝酸银溶液,若无白色沉淀,证明沉淀已洗净。
(2)KHC2O4标准液为酸性溶液,故采用酸式滴定管。滴定终点是高锰酸钾溶液消耗完,紫色褪去,故答案为:最后一滴标准液滴入时,溶液变为无色且半分钟内不恢复。
(3)根据题意可知:酸性高锰酸钾将SO2氧化后,多余的高锰酸钾再与KHC2O4标准液反应,反应关系为:5SO2~2KMnO4 5KHC2O4~2KMnO4,则有:
0.1mol/L×0.01L××+ ××SO2%=0.200mol/L×0.2L 解得:SO2%=90%
Ⅲ.根据实验目的,分析装置可知:装置A作用是除去SO2;装置B的作用是检验SO2是否除尽;装置C的作用是验证气体Y中是否含有CO2;装置D的作用是干燥气体;装置E、F的作用是验证气体Y中是否含有H2。
(1)仪器D是U型管;B中试剂的作用是检验SO2是否除尽;
(2)SO2和CO2都可以使澄清石灰水变浑浊,一定要先检验SO2,然后再除去SO2,在确保SO2已经除净的情况下检验CO2,品红溶液不褪色就可以证明SO2已经除净,如果此时澄清石灰水变浑浊,则说明气体Y中含有CO2。
(3)空气中的水蒸气进入F装置,也可使无水硫酸铜变蓝色,所以不合理。