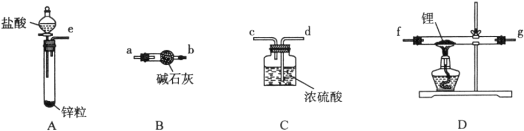
题目内容
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1) Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为_________________________________。
(2) 固体氧化物电解池(SOEC)用于高温电解CO2和H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如右图。
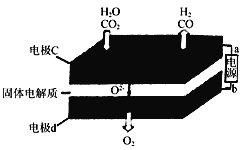
① b为电源的________(填“正极”或“负极”)。
② 写出电极c发生的电极反应式: __________ ______、 __________________ ______。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g)。对此反应进行如下研究:
CH3OH(g)。对此反应进行如下研究:
某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为________,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4) 已知:

若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) ![]() CH3OH(l)的ΔH,
CH3OH(l)的ΔH,
则ΔH=______ ____。
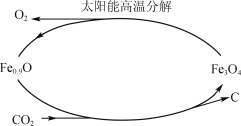
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化 过程如下图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
【答案】(1) Li2CO3+Li2SiO3 ![]() CO2+Li4SiO4
CO2+Li4SiO4
(2)① 正极; ② CO2+2e-===CO+O2-;H2O+2e-===H2+O2-
(3)50; 向逆反应方向 (4)ΔH=2ΔH1-ΔH2-ΔH3 (5)0.1
【解析】
试题分析:(1)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以700℃时反应的化学方程式为:Li2CO3+Li2SiO3![]() CO2+Li4SiO4,故答案为:Li2CO3+Li2SiO3
CO2+Li4SiO4,故答案为:Li2CO3+Li2SiO3![]() CO2+Li4SiO4;
CO2+Li4SiO4;
(2)①CO2+H2O![]() CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,故答案为:正极;
CO+H2+O2,二氧化碳中的碳元素化合价降低,被还原,水中的氢元素化合价降低被还原,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应生成氧气,所以电极d为阳极,所以b为电源的正极,故答案为:正极;
②二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O
+2e-=H2+O2-,故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;
(3) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始:1.2mol 1mol 0
转化:0.4mol 0.8mol 0.4mol
平衡:0.8mol 0.2mol 0.4mol
所以:k=![]() =50(mol/L)-2,
=50(mol/L)-2,
此时向容器中再通入0.35molCO气体,假设平衡不移动时,此时容器体积为:2L×![]() =2.5L,则浓度商Qc=
=2.5L,则浓度商Qc= =54.3,大于平衡常数50,平衡向逆反应方向移动,故答案为:50;逆反应方向;
=54.3,大于平衡常数50,平衡向逆反应方向移动,故答案为:50;逆反应方向;
(4)由图反应Ⅰ可知H2(g)+![]() O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+
O2(g)=H2O(l),△H1;由反应Ⅱ可知:CO2(g)=CO(g)+![]() O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+
O2(g),△H2;若甲醇的燃烧热为△H3,所以CH3OH(g)+![]() O2(g)=2H2O(l)+CO2(g),△H3;所以盖斯定律,目标反应为:△H=2△H1-△H2-△H3,故答案为::△H=2△H1-△H2-△H3;
O2(g)=2H2O(l)+CO2(g),△H3;所以盖斯定律,目标反应为:△H=2△H1-△H2-△H3,故答案为::△H=2△H1-△H2-△H3;
(5)依据图示得到化学方程式为:Fe0.9O+0.1CO2=xC+![]() Fe3O4,依据碳原子守恒得到x=0.1,故答案为:0.1。
Fe3O4,依据碳原子守恒得到x=0.1,故答案为:0.1。

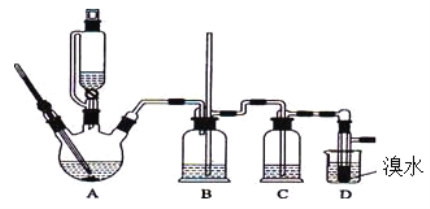
【题目】)实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 。
(2)装置B的作用是__________________________。
(3)在装置C中应加入 (填字母)。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2,最好用 (填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用 的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是
。
(7)判断该制备反应已经结束的最简单方法是 。