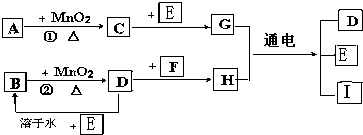
题目内容
19.常温下,下列各组离子在溶液中一定能大量共存的是( )| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝反应产生大量氢气的溶液:Na+、K+、HCO3-、NO3- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ba2+、AlO2-、Cl- |
分析 A.离子之间发生氧化还原反应;
B.与铝反应产生大量氢气的溶液,为非氧化性酸或强碱溶液;
C.pH=12的溶液,显碱性;
D.由水电离产生的c(H+)=10-13mol/L的溶液,为酸或碱溶液.
解答 解:A.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.与铝反应产生大量氢气的溶液,为非氧化性酸或强碱溶液,酸、碱溶液均不能大量存在HCO3-,且酸性溶液中Al、NO3-发生氧化还原反应不生成氢气,故B错误;
C.pH=12的溶液,显碱性,该组离子之间不反应,可大量共存,故C正确;
D.由水电离产生的c(H+)=10-13mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在AlO2-,碱溶液中不能大量存在NH4+,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列关于物质的量的叙述中,错误的是( )
| A. | 1 mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012 kg 12C中约含有6.02×1023个碳原子 | |
| C. | 1 mol水中含有2 molH和1 molO | |
| D. | 1 mol氦气含有6.02×1023个原子 |
7.现有下列十种物质:①H2 ②Cu ③Na2O ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体
⑧碘酒 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(填写序号):
(2)⑩在水中的电离方程式为Al2(SO4)3═2Al3++3SO42-.
(3)某金属氯化物MCl3 26.7g,含有0.600mol Cl-.则金属M的摩尔质量为27g/mol.
⑧碘酒 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(填写序号):
| 分类标准 | 混合物 | 氧化物 | 电解质 |
| 属于该类的物质 |
(3)某金属氯化物MCl3 26.7g,含有0.600mol Cl-.则金属M的摩尔质量为27g/mol.
4.取pH均等于2的盐酸和醋酸各100L,分别稀释2倍后,再分别加入足量的锌粉,在相同条件下充分反应,有关叙述正确的是( )
| A. | 醋酸与锌粉反应放出的氢气少 | |
| B. | 盐酸和醋酸与锌反应放出氢气一样多 | |
| C. | 醋酸与锌反应速率大 | |
| D. | 盐酸、醋酸与锌反应的速率一样大 |
11.下列关于物质分类的说法不正确的是( )
| A. | 冰和干冰都是化合物 | B. | 纯碱是碱 | ||
| C. | K2SO4和K2CO3均属于钾盐 | D. | 豆浆是胶体 |
8. 反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1,在条件下温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1,在条件下温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1,在条件下温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1,在条件下温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | 由状态B到状态A,可以用加热的方法 | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | A、C两点的反应速率:A>C | |
| D. | A、C两点气体的平均相对分子质量:A>C |
9.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物,重新达平衡后,HCl的体积分数不变 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应 |
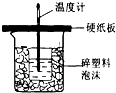 中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量.某学生想通过测反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量.某学生想通过测反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: