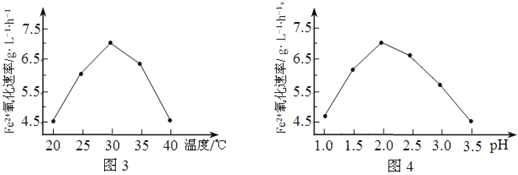
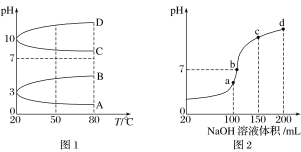
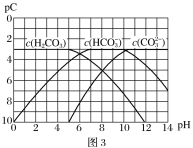
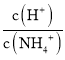题目内容
【题目】次硫酸氢钠甲醛(xNaHSO2·yHCHO·zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:
①准确称取1.540 0 g样品,完全溶于水配成100 mL溶液;
② 取25.00 mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10 mol·L-1;
③ 另取25.00 mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。
次硫酸氢钠甲醛和碘反应的方程式如下:xNaHSO2·yHCHO·zH2O+I2―→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.582 5 g白色固体时,需要消耗碘的质量为________。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式________________________________。
(3)通过计算确定次硫酸氢钠甲醛的组成(写出计算过程)。__________________________
【答案】1.27g 2HCHO+OH-===CH3OH+HCOO- 25.00 mL溶液中:n(NaHSO2)=n(NaHSO4) =n( BaSO4)=0.582 5 g/233g·mol-1=0.002 5 mol,n(HCHO) =0.002 5 mol;
100 mL 溶液中:
n(NaHSO2)= 4×0.002 5 mol=0.01 mol,n(HCHO)=4×0.002 5 mol=0.01 mol,
n(H2O)=![]() =0.02 mol,x∶y∶z=n(NaHSO2)∶n(HCHO)∶n(H2O)=0.01∶0.01∶0.02 =1∶1∶2;
=0.02 mol,x∶y∶z=n(NaHSO2)∶n(HCHO)∶n(H2O)=0.01∶0.01∶0.02 =1∶1∶2;
所以次硫酸氢钠甲醛的化学式为NaHSO2·HCHO·2H2O。
【解析】
(1)根据次硫酸氢钠甲醛和碘单质之间反应的化学反应方程式来计算即可;
(2)甲醛会发生自身氧化还原反应,被氧化为甲酸,被还原为甲醇;
(3)根据元素守恒结合物质之间的反应情况来计算。
(1)0.5825g白色固体为硫酸钡,物质的量是![]() =0.0025mol,xNaHSO2·yHCHO·zH2O中S元素的化合价为+2价,失去4个电子升高到+6价,而碘单质得到2个电子生成碘离子,则碘的物质的量是xNaHSO2·yHCHO·zH2O的2倍,根据元素守恒,则消耗的碘单质的物质的量是生成硫酸钡物质的量的2倍,所以消耗碘的质量是0.0025mol×2×254g/mol=1.27g;
=0.0025mol,xNaHSO2·yHCHO·zH2O中S元素的化合价为+2价,失去4个电子升高到+6价,而碘单质得到2个电子生成碘离子,则碘的物质的量是xNaHSO2·yHCHO·zH2O的2倍,根据元素守恒,则消耗的碘单质的物质的量是生成硫酸钡物质的量的2倍,所以消耗碘的质量是0.0025mol×2×254g/mol=1.27g;
(2)甲醛中C元素的化合价是0价,在碱性条件下发生自身氧化还原反应,生成两种有机物,甲醛被氧化为甲酸,被还原为甲醇,甲酸与碱反应生成甲酸盐,所以离子方程式是2HCHO+OH-===CH3OH+HCOO-;
(3)根据每步中的实验数据可知计算甲醛和NaHSO2的物质的量,从而可计算水的物质的量,三种物质的物质的量之比即为x、y、z之比。
根据②25.00 mL溶液中:n(NaHSO2)=n(NaHSO4) =n( BaSO4)=![]() =0.0025 mol,n(HCHO)=0.0025 mol;
=0.0025 mol,n(HCHO)=0.0025 mol;
100 mL溶液中:
n(NaHSO2)=4×0.0025mol=0.01mol,n(HCHO)=4×0.0025mol=0.01 mol,
n(H2O)=![]() =0.02 mol,
=0.02 mol,
x∶y∶z=n(NaHSO2)∶n(HCHO)∶n(H2O)=0.01∶0.01∶0.02 =1∶1∶2;
所以次硫酸氢钠甲醛的化学式为NaHSO2·HCHO·2H2O。

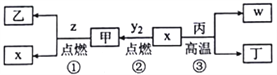
【题目】下列实验中,方案Ⅰ和方案Ⅱ均可行,且方案Ⅱ更合理的是
实验目的 | 方案Ⅰ | 方案Ⅱ | |
A | 除去乙酸乙酯中的少量乙酸 | 加饱和 | 蒸馏 |
B | 鉴别碳酸钠和碳酸氢钠溶液 | 分别滴加澄清石灰水 | 分别加热两溶液 |
C | 检验亚硫酸钠是否被氧化 | 滴入 | 滴入盐酸酸化的 |
D | 比较氯元素、碘元素的非金属性强弱 | 分别加热氯化氢、碘化氢,比较热稳定性 | 在淀粉碘化钾试纸上滴加氯水 |
A.AB.BC.CD.D
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.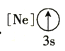 B.
B.![]() C.
C.![]() D.
D.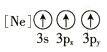
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与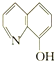 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A.4个B.3个C.2个D.1个