题目内容
12.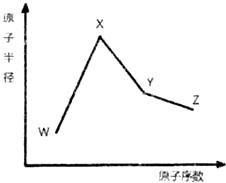 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.(1)X位于元素周期表中的位置第三周期第IA族; W与X形成原子个数比1:1的物质,该物质与H2O反应的化方程序式(在化学式中标出质量数18):2Na218O2+4H2O=4NaOH+2H218O+18O2↑
(2)X的单质和Y的单质相比,熔点较高的是Si(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式)
(3)Y和Z形成的化合物和足量的水反应,生成一种弱酸和一种强酸,该反应的化学方程式:SiCl4+3H2O=H2SiO3↓+4HCl.
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的原子半径在同周期主族元素中最小,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的原子半径在同周期主族元素中最小,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素.
(1)X为Na元素,位于元素周期表中第三周期第IA族;W与X形成原子个数比1:1的物质为Na218O2,该物质与H2O反应的化方程序式(在化学式中标出质量数18)为:2Na218O2+4H2O=4NaOH+2H218O+18O2↑,
故答案为:第三周期第IA族;2Na218O2+4H2O=4NaOH+2H218O+18O2↑;
(2)X单质为钠,属于金属晶体,其熔点比较低,Y的单质为硅,属于原子晶体,沸点高于Na,由于非金属性Cl>Br,故氢化物稳定性HCl>HBr,
故答案为:Si;HCl;
(3)Y和Z形成的化合物为SiCl4,和足量的水反应,生成一种弱酸和一种强酸,应得到硅酸与HCl,该反应的化学方程式:SiCl4+3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+3H2O=H2SiO3↓+4HCl.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,侧重对化学用语与元素周期律的考查,有利于学生对基础知识的巩固,(1)中方程式书写为易错点,关键是明确反应原理,难度中等.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案| A. | $\frac{12W}{n}$ | B. | $\frac{12n}{W}$ | C. | 6.02×1023W | D. | 12×6.02×1023W |
| A. | ETFE的结构中,存在-CF2-CH2-CF2-CH2-连接方式 | |
| B. | 四氟乙烯与乙烯发生缩聚反应得到ETFE | |
| C. | 以乙烯为原料经过加成反应、取代反应可制得乙二醇 | |
| D. | ETFE材料是热固型(体形结构)的塑料 |
| A. | 达平衡时,A2的正反应速率与B2的逆反应速率相等 | |
| B. | b≤0.2mol/L | |
| C. | 其它条件不变,在反应过程中使用了催化剂,可提高 A2、B2的转化率 | |
| D. | 该反应达平衡时气体物质的量浓度之和小于(a+b+0.3)mol/L |
| A. | MgBr2和KCl | B. | Cl2和HCl | C. | HI和NaI | D. | Na2O2和H2O2 |
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量⑧混合气体的总体积.
| A. | ①③④⑤ | B. | ①②③④⑤⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |

| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
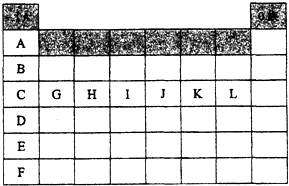 如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)
如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)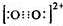 .CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体
.CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体