题目内容
17.下列各组物质中,化学键类型完全相同的是( )| A. | MgBr2和KCl | B. | Cl2和HCl | C. | HI和NaI | D. | Na2O2和H2O2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,同种非金属元素之间形成非极性共价键、不同非金属元素之间形成极性共价键,据此分析解答.
解答 解:A.MgBr2和KCl中只存在阴阳离子形成的离子键,所以化学键类型相同,故A正确;
B.Cl2是共价键,而HCl中氢原子与氯原子之间只存共价键,但前者是非极性共价键、后者是极性共价键,所以化学键类型不相同,故B错误;
C.HI中H原子和I原子之间存在极性键,NaI中钠离子和碘离子之间存在离子键,所以化学键类型不相同,故C错误;
D.Na2O2中存在离子键和共价键、H2O2中只存在共价键,所以化学键类型不同,故D错误;
故选A.
点评 本题考查了化学键的判断,根据物质的构成微粒及微粒间的作用力来分析解答,知道离子键、共价键的区别,题目难度不大.

练习册系列答案
相关题目
4.可用于分离或提纯物质的方法有( )
| A. | 过滤 | B. | 加热 | C. | 蒸发 | D. | 洗气 |
8.某有机物结构简式如下: 它的名称为( )
它的名称为( )
 它的名称为( )
它的名称为( )| A. | 3,3-二甲基-2-乙基-戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,3,3-三甲基戊烷 | D. | 3,3,4-三甲基己烷 |
5.已知标准状况下11.2L的某气体分子的质量为22g,则该气体的摩尔质量是( )
| A. | 44g | B. | 22g | C. | 44g/mol | D. | 22g/mol |
2.有CO、H2、HCHO(甲醛)三种混合气体12g,在足量O2中完全燃烧后,将生成的产物全部通入过量的Na2O2,充分吸收后,固体增加的质量是( )
| A. | 14.2 g | B. | 16.7 g | C. | 12.6g | D. | 12 g |
9.如图装置或操作不合理或不能达到实验目的是( )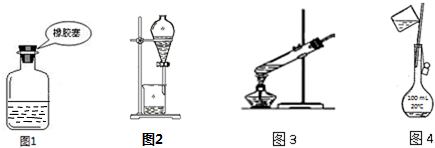

| A. | 图1装置:存放NaOH溶液 | |
| B. | 图2装置:分离乙酸乙酯和水 | |
| C. | 图3装置:葡萄糖的银镜反应 | |
| D. | 图4装置:配制 100 mL 1 mol/L NaCl溶液 |
6.铅的冶炼、加工同样会使水体中重金属铅的含量增大造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的浓度分数α随溶液pH 变化的关系如图所示:
(1)往含Pb2+的溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子除H+、Na+外还有Pb2+、Pb(OH)+,pH=9时,主要反应的离子方程式为Pb2++2OH-═Pb(OH)2↓.
(2)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是Fe3+.
(3)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+.则脱铅的最合适pH 范围为B(填字母).
A.4~5B.6~7C.9~10D.11~12.

(1)往含Pb2+的溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子除H+、Na+外还有Pb2+、Pb(OH)+,pH=9时,主要反应的离子方程式为Pb2++2OH-═Pb(OH)2↓.
(2)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(3)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+.则脱铅的最合适pH 范围为B(填字母).
A.4~5B.6~7C.9~10D.11~12.
7.如图是元素周期表的一部分,针对表中的①-⑩中元素,填写下列空格:
(1)在这10种元素中,化学性质最不活泼的元素是Ar(填元素符号),金属性最强的元素是钠(填元素名称),最活泼的非金属单质是F2(化学式),元素④对应的离子结构示意图为 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;
(2)给出的第二周期的几种元素中,原子半径最大的是C (填元素符号).
(3)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是NaOH,元素⑤与⑥的最高价氧化物的水化物之间相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)元素③与⑦能以共价键(填化学键类型)结合成原子晶体(填晶体类型).
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;(2)给出的第二周期的几种元素中,原子半径最大的是C (填元素符号).
(3)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是NaOH,元素⑤与⑥的最高价氧化物的水化物之间相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)元素③与⑦能以共价键(填化学键类型)结合成原子晶体(填晶体类型).
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.