题目内容
2.如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是( )
| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
分析 由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A?2B+C,根据v=$\frac{△c}{△t}$计算反应速率.
解答 解:A、由图象可知,A的物质的量浓度减小,B和C的物质的量浓度增加,则A为反应物,B和C为生成物,故A正确;
B、由图可知前2 minA的△c(A)=0.2mol/L,所以v(C)=$\frac{0.2mol/L}{2min}$=0.1 mol•L-1•min-1,故B正确;
C、根据图象不能确定该反应的反应热,不能判断温度对平衡移动的影响,故C错误;
D、由反应的浓度的变化之比等于化学计量数之比可得:△c(A):△c(B):△c(C)=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,则反应的化学方程式为2A?2B+C,故D正确;
故选C.
点评 本题考查化学平衡图象问题,题目难度不大,注意根据图象书写反应的化学方程式,图是物质的量浓度的变化曲线,不能判断温度对平衡移动的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.已知C-C键可以绕键轴自由旋转,结构简式为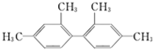 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至多有26个原子处于同一平面上 | |
| C. | 该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 该烃属于苯的同系物 |
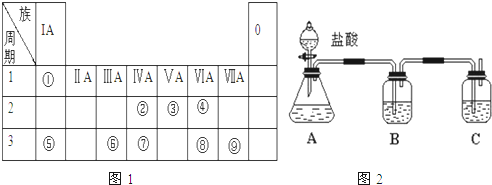
7.如图是元素周期表的一部分,针对表中的①-⑩中元素,填写下列空格:
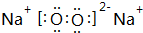
(1)在这10种元素中,化学性质最不活泼的元素是Ar(填元素符号),金属性最强的元素是钠(填元素名称),最活泼的非金属单质是F2(化学式),元素④对应的离子结构示意图为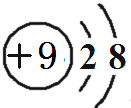 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;
(2)给出的第二周期的几种元素中,原子半径最大的是C (填元素符号).
(3)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是NaOH,元素⑤与⑥的最高价氧化物的水化物之间相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)元素③与⑦能以共价键(填化学键类型)结合成原子晶体(填晶体类型).
| 族周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
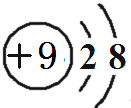 .元素①的最高价氧化物的电子式:
.元素①的最高价氧化物的电子式: ;
;(2)给出的第二周期的几种元素中,原子半径最大的是C (填元素符号).
(3)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是NaOH,元素⑤与⑥的最高价氧化物的水化物之间相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)元素③与⑦能以共价键(填化学键类型)结合成原子晶体(填晶体类型).
14.下列说法正确的是( )
| A. | 镁在空气中和纯净氧气中的燃烧产物只有MgO | |
| B. | 硫在空气中的燃烧产物是SO2,在纯净氧气中的燃烧产物是SO3 | |
| C. | 钠在敞口容器中长期放置和在空气中燃烧的产物都是Na2O2 | |
| D. | 浓H2SO4和浓盐酸敞口放置在空气中,其溶质的质量分数都将减小 |
11.X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料,X、Y、Z同周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-. 下列说法正确的是( )
| A. | X和W组成的化合物属于分子晶体 | |
| B. | Y的气态氢化物比Z的气态氢化物稳定 | |
| C. | X的单质既能与NaOH溶液反应,又能与氢氟酸反应 | |
| D. | 向KI-淀粉溶液中通入某气体后变蓝,则该气体一定是Z的单质 |
12.有下列化合物:①Na2O2、②Fe(OH)3、③FeCl2、④CuS、⑤CuI2、⑥NaHCO3,其中不能通过化合反应制得的是( )
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ④⑤ | D. | ①②③⑤ |
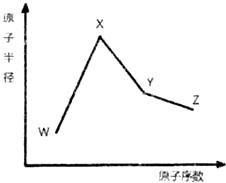 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.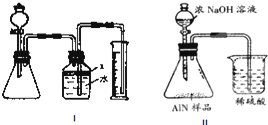
 .
.