题目内容
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g)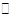 H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是
| A.采用高温 |
| B.采用高压 |
| C.寻找更高效的催化剂 |
| D.减小体系内CO2浓度 |
第一步:2NH3(l)+CO2(g)
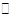 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1第二步:H2NCOONH4(l)
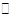 H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定,总反应进行到 min时到达平衡。
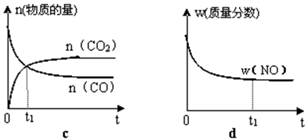
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2 0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H= kJ·mol-1
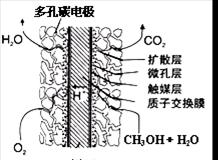
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为 。
(1)A B C (2分)
(2)①2(2分); 55(2分)② >(2分)
(3)①CO(NH2)2+NO+NO2=CO2+2N2+2H2O(2分)
②―1627.2kJ·mol―1(2分)
(4)CO(NH2)2+H2O―6=CO2+N2+6H+(2分)
解析试题分析:(1)2NH3(l)+CO2(g)=H2O(l)+H2NCONH2(l)△H=-103.7kJ·mol-1,反应是放热反应,反应前后气体体积减小;有利于提高尿素的生成速率需要依据影响化学反应速率的因素进行分析,
A.采用高温,反应是放热反应,平衡逆向进行,但反应速率增大,A符合;
B.反应由气体参加,反应前后气体体积减小,采用高压,增大压强,反应正向进行,反应速率增大,B符合;
C.寻找更高效的催化剂,催化剂可以加快反应速率,但不改变平衡,C符合;
D.减小体系内CO2浓度平衡逆向进行,反应速率减小,D不符合;
故答案为:ABC;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,所以已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步决定,由图象变化可知当进行到55分钟时,反应达到平衡,
故答案为:2;55;
②第二步反应的平衡常数K随温度的升高增大,说明反应是吸热反应,△H2>0,故答案为:>;
(3)①工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应,生成二氧化碳、氮气和水,反应的化学方程式为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O,故答案为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O;
②a、N2(g)+O2(g)═2NO(g).△H=180.6kJ·mol-1
b、N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ·mol-1
c、2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ·mol-1
依据盖斯定律c×3-2×b-2×a得到,4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2KJ·mol-1,故答案为:―1627.2KJ·mol-1;
(4)依据尿素燃料电池结构,尿素在负极发生氧化反应失电子生成二氧化碳和氮气,氧气在正极得到电子发生还原反应生成氢氧根离子,酸性介质中实际生成水,负极电极反应为:
CO(NH2)2+H2O-6e-=CO2+N2+6H+;正极电极反应为O2+4H++4e-=2H2O,故答案为:CO(NH2)2+H2O-6e-=CO2+N2+6H+.
考点:化学平衡的影响因素;用盖斯定律进行有关反应热的计算;电极反应和电池反应方程式;物质的量或浓度随时间的变化曲线

 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。

 cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0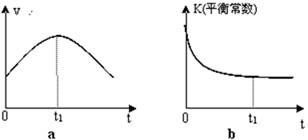
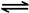 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0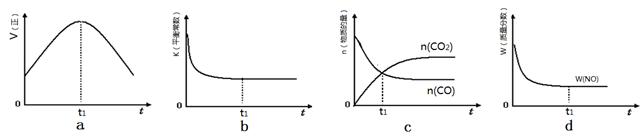
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 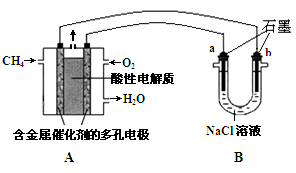
 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示: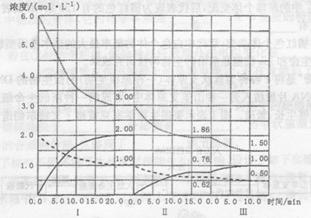
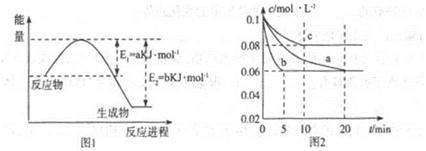
 2NH3(g)△H<0
2NH3(g)△H<0