题目内容
4.实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:(1)配制250mL0.1mol/L的盐酸溶液. 应量取质量分数为36.5%浓盐酸体积2.1mL,除250mL容量瓶外还需要的其它仪器量筒、烧杯、玻璃棒、胶头滴管.
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)溶液注入容量瓶前需恢复到室温,这是因为溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小,溶液浓度偏大
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作偏低;b.加蒸馏水时不慎超过了刻度偏低;c.定容时俯视偏高.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,依据溶液稀释前后溶质的物质的量不变计算浓盐酸的体积;配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,依据配制溶液的步骤选择合适的仪器;
(2)依据配制溶液的一般步骤解答;
(3)溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏小;
(4)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)浓盐酸的物质的量浓度为:C=$\frac{1000ρω}{M}$=1000x1.18x36.5%/36.5═11.8mol/L;设量取浓盐酸的体积为V,11.8mol/L×V=0.1mol/L×0.25L,V=0.0021L=2.1mL;
配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,所需的仪器有量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以除容量瓶外还需要的其它仪器有量筒、烧杯、玻璃棒、胶头滴管,
故答案为:2.1;量筒、烧杯、玻璃棒、胶头滴管;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,所以配制时,其正确的操作顺序是BCAFED,故答案为:BCAFED;
(3)溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏大;
故答案为:溶液有热胀冷缩的性质,如果不冷却到室温,会导致溶液的体积偏大;
(4)a.没有进行A操作,导致溶质的物质的量偏小,配制溶液的浓度偏低,
故答案为:偏低;
b.加蒸馏水时不慎超过了刻度,导致溶液的体积偏大,配制溶液的浓度偏低,
故答案为:偏低;
c.定容时俯视偏低,导致溶液的体积偏小,配制溶液的浓度偏高,
故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理和过程是解题关键,题目难度不大.

| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
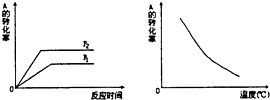 如图所示,可逆反应:mA(g)+nB(g)?xC(g),在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是( )
如图所示,可逆反应:mA(g)+nB(g)?xC(g),在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应和反应方程式中A、B、C的系数的判断中,正确的是( )| A. | 放热,m+n>x | B. | 放热,m+n<x | C. | 吸热,m+n<x | D. | 吸热,m+n>x |
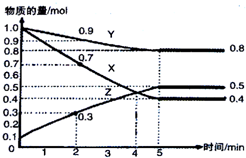 某温度时,在2L容器中X、Y、Z三种气态物质随时间的变化关系曲线如图所示.下列说法正确的是( )
某温度时,在2L容器中X、Y、Z三种气态物质随时间的变化关系曲线如图所示.下列说法正确的是( )| A. | 反应开始到5min,用X表示的反应速率为0.3mol•L-1•min-1 | |
| B. | 反应开始到2min,用Z表示的反应速率为0.05mol•L-1•min-1 | |
| C. | 反应开始到4min反应达到平衡状态 | |
| D. | 反应的化学方程式为:2X(g)+Y(g)?3Z(g) |
| A. | 金刚石的网状结构中,由共价键形成的碳原子环,其中最小的环上有6个碳原子 | |
| B. | 干冰晶体熔化时,1mol干冰要断裂2mol碳氧双键 | |
| C. | 在氯化钠晶体中,每个Na+(或Cl-)的周围紧邻6个Cl-(或6个Na+) | |
| D. | 在氯化铯晶体中,每个Cs+周围紧邻8个Cl-,每个Cl-周围也紧邻8个Cs+ |
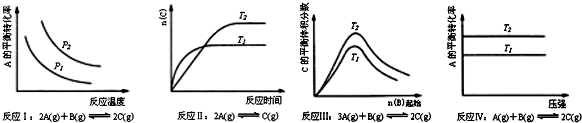
根据以上规律判断,上列结论正确的是( )
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1<T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1;或△H>0,T2<T1 | D. | 反应Ⅳ:△H<0,T2<T1或△H>0,T2>T1 |