题目内容
11.工业制ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是( )| A. | NaClO3在反应中化合价降低,失去电子 | |
| B. | SO2在反应中发生氧化反应 | |
| C. | 2mol氧化剂在反应中得到2mol电子 | |
| D. | H2SO4在反应中作氧化剂 |
分析 在反应2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4中,Cl元素化合价由+5价降低到+4价,被还原,NaClO3为氧化剂,S元素化合价由+4价升高到+6价,被氧化,SO2为还原剂,结合氧化还原反应反应中氧化剂和还原剂之间得失电子数目相等解答该题.
解答 解:A.Cl元素化合价降低,被还原,NaClO3在反应中得电子,故A错误;
B.S元素化合价升高,被氧化,SO2在反应中发生氧化反应,故B正确;
C.由方程式可知,Cl元素化合价降低1价,则2mol氧化剂在反应中得到电子数目为2NA,故C正确;
D.H2SO4中各元素的化合价都没有变化,在反应中起到酸性的作用,故D错误.
故选BC.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
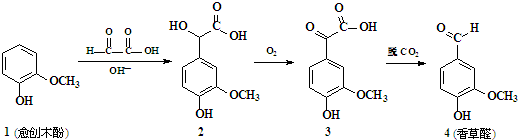
1.香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如图所示.下列说法正确的是( )【提示 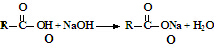 】
】
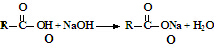 】
】
| A. | 1→2、2→3的转化分别为取代反应和消去反应 | |
| B. | 化合物2在一定条件下可发生加聚反应 | |
| C. | 可用FeCl3溶液检验制得的香草醛中是否混有化合物3 | |
| D. | 等物质的量的四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:2:2:1 |
19.标准状况下有以下四种气体:①6.72L CH4 ②3.01×1023 个HCl分子 ③13.6g H2S④0.2mol NH3.下列对四种气体的关系从小到大表示不正确的是( )
| A. | 物质的量:④<①<②<③ | B. | 体积:④<①<③<② | ||
| C. | 质量:④<①<③<② | D. | 氢原子个数:②<④<③<① |
16.下列分类标准正确的是( )
| A. | 化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行) | |
| B. | 分散系分为:溶液、胶体、浊液(标准:能否透过滤纸) | |
| C. | 化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化) | |
| D. | 化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电) |
3.下列说法正确的是( )
| A. | 冰中每个水分子平均形成两个氢键 | |
| B. | 冰、“可燃冰”、干冰都具有分子密堆积特征 | |
| C. | 分子晶体中一定不存在单个的原子 | |
| D. | “可燃冰”不属于分子晶体 |
4.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | SO2具有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |