题目内容
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
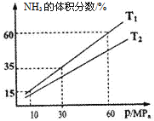
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;列出计算式即可,无需化简)。
②T1_____________T2(填“>”、“<”或“=”)。
③达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将______(填“增大”“减小”或“不变”)
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g)→2N*;H2(g)→2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H
NH*;NH*+H![]() NH2*;NH2* +H*
NH2*;NH2* +H*![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
【答案】391 AD 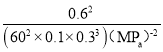 < 不变 > 活化能越大,反应速率越慢
< 不变 > 活化能越大,反应速率越慢
【解析】
(1)焓变利用键能求算时,△H=反应物键能和-生成物键能和,据此分析;
(2)提高合成氨平衡产率,即平衡正向移动,降低温度,平衡正向移动,当增大反应压强,平衡会向着体积减小的方向进行,催化剂对平衡没有影响;
(3)①若体系在T1、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,根据三段式,求得平衡时各物质的物质的量,从而得到答案;
②放热反应,降低温度,平衡正向移动,氨气的体积分数增大;
③恒温恒压,温度不变,平衡常数不变,据此分析解答;
(4)第一步为慢反应,说明要反应需要从外界吸收的热量多,活化分子数少,活化能大。
(1)设1mol N-H键需要的能量是xkJ,由△H=反应物键能和-生成物键能和,得-92kJ=436kJ×3+946kJ-6x,解得:x=391kJ;
(2)提高合成氨平衡产率,即平衡正向移动,N2(g)+3H2(g)2NH3(g)△H=-92kJmol-1这是一个放热反应,降低温度,平衡正向移动,反应前后,体积缩小,当增大反应压强,平衡会向着体积减小的方向进行,即正向,催化剂只会加快反应速率,对平衡没有影响;故答案为AD;
(3)①若体系在T1、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)2NH3(g)
开始(mol) 1 3 0
反应(mol) 0.5x 1.5x x
平衡(mol) 1-0.5x 3-1.5x x
![]() =60%,解得x=1.5mol;分压=总压×物质的量分数,平衡时N2、H2、NH3物质的量分数分别为0.1、0.3、0.6,得到平衡常数K=
=60%,解得x=1.5mol;分压=总压×物质的量分数,平衡时N2、H2、NH3物质的量分数分别为0.1、0.3、0.6,得到平衡常数K=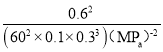 ;
;
②N2(g)+3H2(g)2NH3(g)△H=-92kJmol-1这是一个放热反应,降低温度,平衡正向移动,氨气的体积分数增大,故T1<T2;
③恒温恒压,温度不变,平衡常数不变,达到平衡后,再向容器中充入适量氨气,达到新平衡时,各物质的浓度都不变,故c(H2)不变;
(4)第一步为慢反应,说明要反应需要从外界吸收的热量多,活化分子数少,活化能大,即E1>E2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
CO的燃烧热为________。CO将NO2还原为单质的热化学方程式为______________。
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g) ![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:酸性HCO3-<HClO<H2CO3)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填填“小于”,“大于”)。





