题目内容
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
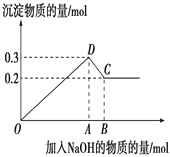
(1)写出代表下列线段发生的反应的离子方程式:
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量之比为_____________。
(3)图中B点时所加入溶液中含NaOH为________mol
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为________________________________。
【答案】 Al(OH)3+OH-=AlO2-+2H2O 2∶1 0.8 mol 1.2 mol·L﹣1 、3.6 mol·L﹣1
【解析】试题分析:本题考查与Al(OH)3有关的图像的计算,Al3+与强碱反应的计算。在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液,图像中OD段发生的反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl;Mg(OH)2不溶于NaOH溶液,Al(OH)3溶于NaOH溶液,DC段发生的反应为Al(OH)3+NaOH=NaAlO2+2H2O。
(1)DC段为Al(OH)3溶于NaOH生成NaAlO2和H2O,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(2)根据纵坐标,Mg(OH)2物质的量为0.2mol,n(Mg2+)=n[Mg(OH)2]=0.2mol,Al(OH)3物质的量为0.3mol-0.2mol=0.1mol, n(Al3+)=n[Al(OH)3]=0.1mol,原溶液中Mg2+、Al3+物质的量之比为0.2mol:0.1mol=2:1。
(3)根据反应Mg2++2OH-=Mg(OH)2↓,Mg2+消耗的NaOH物质的量为0.2mol![]() 2=0.4mol;B点时Al3+完全转化为AlO2-,根据反应Al3++4OH-=AlO2-+2H2O,到B点时Al3+消耗的NaOH物质的量为0.1mol
2=0.4mol;B点时Al3+完全转化为AlO2-,根据反应Al3++4OH-=AlO2-+2H2O,到B点时Al3+消耗的NaOH物质的量为0.1mol![]() 4=0.4mol;图中B点所加溶液中含NaOH物质的量为0.4mol+0.4mol=0.8mol。
4=0.4mol;图中B点所加溶液中含NaOH物质的量为0.4mol+0.4mol=0.8mol。
(4)n(AlCl3)=2mol/L![]() 0.05L=0.1mol,n[Al(OH)3]=
0.05L=0.1mol,n[Al(OH)3]= ![]() =0.04mol
=0.04mol![]() 0.1mol。可能存在两种情况,①若加入的KOH溶液较少使部分AlCl3反应生成Al(OH)3沉淀,根据反应AlCl3+3KOH=3KCl+Al(OH)3↓,消耗的KOH物质的量n(KOH)= 3n[Al(OH)3]=3
0.1mol。可能存在两种情况,①若加入的KOH溶液较少使部分AlCl3反应生成Al(OH)3沉淀,根据反应AlCl3+3KOH=3KCl+Al(OH)3↓,消耗的KOH物质的量n(KOH)= 3n[Al(OH)3]=3![]() 0.04mol=0.12mol,c(KOH)=
0.04mol=0.12mol,c(KOH)=![]() =1.2mol/L;②若加入的KOH使AlCl3完全沉淀,KOH又溶解了部分Al(OH)3,AlCl3完全沉淀消耗KOH物质的量为0.1mol
=1.2mol/L;②若加入的KOH使AlCl3完全沉淀,KOH又溶解了部分Al(OH)3,AlCl3完全沉淀消耗KOH物质的量为0.1mol![]() 3=0.3mol,生成Al(OH)3沉淀的最大值为0.1mol,则溶解的Al(OH)3物质的量为0.1mol-0.04mol=0.06mol,根据反应Al(OH)3+KOH=KAlO2+2H2O,溶解Al(span>OH)3消耗的KOH物质的量为0.06mol,加入的KOH物质的量为0.3mol+0.06mol=0.36mol,c(KOH)=
3=0.3mol,生成Al(OH)3沉淀的最大值为0.1mol,则溶解的Al(OH)3物质的量为0.1mol-0.04mol=0.06mol,根据反应Al(OH)3+KOH=KAlO2+2H2O,溶解Al(span>OH)3消耗的KOH物质的量为0.06mol,加入的KOH物质的量为0.3mol+0.06mol=0.36mol,c(KOH)=![]() =3.6mol/L;KOH物质的量浓度可能为1.2mol/L或3.6mol/L。
=3.6mol/L;KOH物质的量浓度可能为1.2mol/L或3.6mol/L。