题目内容
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 | I的还原性强于Cl |
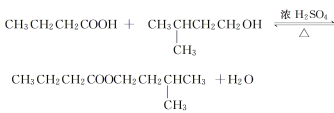
B | 向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去 | 该气体一定是乙烯 |
C | 测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大 | C的非金属性比Si强 |
D | 向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 | 1-溴丙烷没有水解 |
A.AB.BC.CD.D
【答案】A
【解析】
A.氯水的强氧化性强于![]() ,可将
,可将![]() 氧化为
氧化为![]() ,
,![]() 又会被四氯化碳萃取,进入有机相,四氯化碳密度大于水,在下层,因此下层溶液呈紫红色,A项正确;
又会被四氯化碳萃取,进入有机相,四氯化碳密度大于水,在下层,因此下层溶液呈紫红色,A项正确;
B.能使酸性高锰酸钾溶液褪色的不一定是乙烯,也有可能是![]() 被还原产生了
被还原产生了![]() ,
,![]() 使酸性高锰酸钾溶液褪色,B项错误;
使酸性高锰酸钾溶液褪色,B项错误;
C.应该在相同浓度下比较二者的碱性,C项错误;
D.反应后的溶液是碱性的,![]() 会和
会和![]() 反应干扰
反应干扰![]() 的检测,因此应先加入稀硝酸,再加入硝酸银来检验,D项错误;
的检测,因此应先加入稀硝酸,再加入硝酸银来检验,D项错误;
答案选A。

 全能练考卷系列答案
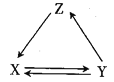
全能练考卷系列答案【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
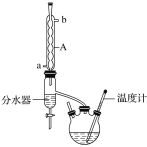
【题目】丁酸异戊酯又称香蕉油,多用于食品和化妆品的香精,实验室用正丁酸与异戊醇反应制备丁酸异戊酯,有关数据和装置示意图如下:
相对分子质量 | 密度(g·cm-3) | 沸点(℃) | 水中溶解性 | |
正丁酸 | 88 | 0.958 7 | 163.5 | 溶 |
异戊醇 | 88 | 0.813 2 | 131 | 微溶 |
丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |
实验步骤:
①如图连接好装置,在三颈烧瓶中加入0.2 mol异戊醇、0.1 mol正丁酸、数滴浓硫酸、5 mL苯和2~3片碎瓷片。充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g。
回答下列问题:
(1)图中A仪器的名称是___________。
(2)在该实验中,三颈烧瓶的容积最适合的是_____(填字母)。
A.50mL B.100mL C.200mL
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____(填字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料
(4)分离提纯过程中加入无水硫酸镁的目的是______________。
(5)在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是_______(填字母)。

(6)本实验的产率是______(保留三位有效数字)。