题目内容
【题目】下列所得溶液的物质的量浓度等于0.1mol/L的是( )
A. 将0.1mol氨气充分溶解在1L水中
B. 将10g质量分数为98%的硫酸与990g水混合
C. 将8g三氧化硫溶于水并配成1L溶液
D. 将0.1mol氧化钾溶于水并配成1L溶液
【答案】C
【解析】
A、没有指明溶液的体积,无法计算物质的量浓度,故A错误;B、题目中没有指明溶液的体积,无法判断物质的量浓度,故B错误;C、SO3溶于水后生成H2SO4,SO3的物质的量等于H2SO4的物质的量,n(SO3)=n(H2SO4)=![]() mol=0.1mol,溶液的体积为1L,则物质的量浓度为0.1mol·L-1,故C正确;D、K2O溶于水后得到KOH,n(K2O)=2n(KOH)=
mol=0.1mol,溶液的体积为1L,则物质的量浓度为0.1mol·L-1,故C正确;D、K2O溶于水后得到KOH,n(K2O)=2n(KOH)=![]() 0.1mol,即n(KOH)=0.05mol,物质的量浓度为0.05/1mol·L-1=0.05mol·L-1,故D错误。
0.1mol,即n(KOH)=0.05mol,物质的量浓度为0.05/1mol·L-1=0.05mol·L-1,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
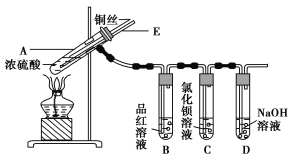
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。