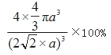题目内容
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)铁元素在周期表中的位置是_______,基态Cu2+的核外电子排布式是__________。元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu>IFe的原因是_________________。
(2)有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为:[Fe(H2NCONH2)6](NO3)3。
①尿素分子中C原子的杂化方式是__________。
②[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”与 Fe(Ⅲ)之间的作用力是_______。根据价层电子对互斥理论推测 NO3-的空间构型为____________。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_______, 原因是______________。
(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,由此可知 FeCl3的晶体类型为______;S和Fe形成的某化合物,其晶胞如图一所示, 则该物质的化学式为__________。

(5)Cu晶体的堆积方式如图二所示,晶体中Cu原子的配位数为_______;设Cu原子半径为a,晶体空间利用率为 _________(用含a 的式子表达,不化简)。
【答案】 4 周期 VIII 族 [Ar]3d9 铜失去1个电子后为3d10,轨道为全充满,相对较稳定,再失去电子较难;而铁失去1个电子后为3d64s1,再失去电子相对较易 sp2 配位键 平面三角形 异硫氰酸( H-N=C=S) 异硫氰酸更易形成分子间氢键 分子晶体 FeS 12 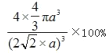
【解析】(1)铁元素是26号,在周期表中的位置是四 周期 VIII 族;基态Cu2+的核外电子排布式是[Ar]3d9;ICu>IFe的原因是 铜失去1个电子后为3d10,轨道为全充满,相对较稳定,再失去电子较难;而铁失去1个电子后为3d64s1,再失去电子相对较易 ;
(2)①尿素分子中C原子形成3个σ键和一个π键,杂化方式是sp2 ; Fe(Ⅲ)提供空轨道,配体H2NCONH2中的两个N原子提供孤电子对,[Fe(H2NCONH2)6](NO3)3 中“H2NCONH2”与 Fe(Ⅲ)之间的作用力是配位键;根据价层电子对互斥理论,NO3―中心原子N的价层电子对为3+(5+1-2×3)/2=3,杂化方式是sp2 ,推测 NO3-的空间构型为平面三角形。(3)硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)沸点较高的是异硫氰酸(H-N=C=S),该分子中N原子电负性较大,且存在N―H键,具备氢键形成的条件,易形成分子间氢键。(4)FeCl3晶体易溶于水和乙醇,用酒精灯加热即可气化,说明FeCl3沸点低,分子极性小,具有分子晶体的特点为分子晶体。根据图一晶胞中Fe的个数为4,S原子的个数为8×1/8+6×1/2=4,故该物质的化学式为FeS;(5)以铜晶胞的一个面心的原子为观察点,该平面和上下两个平面上各有四个原子与中心原子最近且距离相等,共12个,晶体中Cu原子的配位数为12;4个铜原子的体积4×4πa3,晶胞的边长为4a×![]() /2,故空间利用率为
/2,故空间利用率为