题目内容
【题目】我国历史悠久,有灿烂的青铜文明,出土大量的青铜器。研究青铜器中(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )
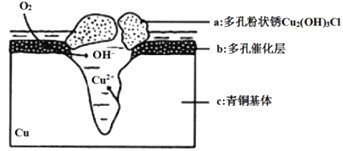
A.青铜器发生电化学腐蚀,图中c作负极,被氧化
B.正极发生的电极反应为O2+4e-+2H2O=4OH-
C.环境中的C1-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
D.若生成2 mol Cu2(OH)3Cl, 则理论上消耗标准状况下O2的体积为22.4 L
【答案】D
【解析】
A. 根据图知,O2得电子生成OH-、Cu失电子生成Cu2+,青铜器发生吸氧腐蚀,则Cu作负极被氧化,腐蚀过程中,负极是a,A正确;
B. O2在正极得电子生成OH-,则正极的电极反应式为:O2+4e-+2H2O=4OH-,B正确;
C. Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成Cu2+、正极上生成OH-,所以该离子反应为Cl-、Cu2+和OH-反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,C正确;
D. 每生成1 mol Cu2(OH)3Cl,需2 mol Cu2+,转移4 mol电子,消耗1 mol O2,则根据转移电子守恒可得生成2 mol Cu2(OH)3Cl,需消耗O2的物质的量n(O2)=![]() =2 mol,则理论上消耗标准状况下O2的体积V=2 mol×22.4 L/mol=44.8 L,D错误;
=2 mol,则理论上消耗标准状况下O2的体积V=2 mol×22.4 L/mol=44.8 L,D错误;
故合理选项是D。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)HSO![]() 的电离平衡常数表达式K=______________________________。
的电离平衡常数表达式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________。