题目内容
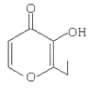
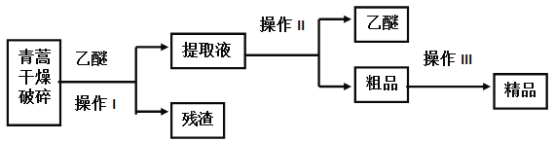
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药,已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法,乙醚浸取法的主要工艺为(如图):
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是 _______________________________。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃________ ,操作Ⅱ的名称是__________。
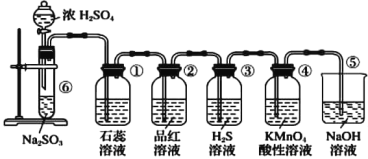
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:

①按上述所给的测量信息,装置的连接顺序应是_____________。(装置可重复使用)
②青蒿素样品的质量为28.2g,用合理改进后的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是_________________。
③要确定该有机物的分子式,还必须知道的数据是__________________________。
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与 ________(填字母)具有相同的性质
A.乙醇 B.乙酸 C.葡萄糖 D.乙酸乙酯
【答案】增大青蒿与乙醚的接触面积,提高青蒿素的浸出率 漏斗 蒸馏 DCEBAA C15H22O5 样品的摩尔质量(或相对分子质量) D
【解析】
青蒿素可溶解在乙醚中,所以青蒿用乙醚溶解后然后过滤,目的是提取青蒿素,过滤后得到残渣和提取液,然后利用蒸馏的方法分离乙醚和粗品,
(1)乙醚可溶解青蒿素;
(2)分离难溶性固体和溶液采用过滤方法;分离互溶的液体采用蒸馏方法;
(3)①实验原理是:测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,确定是否含氧及C、H、O的个数比,求出最简式;因此制备O2后必须除杂(主要是除H2O),明确各装置的作用是解题的前提。A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,据此对各装置进行排序;
②装置A和空气直接接触会使二氧化碳和水蒸气进入影响测定结果;
③根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
④题中该实验方法只能获得有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量或摩尔质量;
(4)根据酯不能溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠进行判断。
青蒿素可溶解在乙醚中,所以青蒿用乙醚溶解后然后过滤,目的是提取青蒿素,过滤后得到残渣和提取液,然后利用蒸馏的方法分离乙醚和粗品,
(1)乙醚可溶解青蒿素,由于青蒿是固体物质,为使固体物质与溶剂充分接触,因此要将干燥的青蒿粉碎,以提取青蒿素;
(2)分离难溶性固体和溶液采用过滤方法,分离互溶的液体采用蒸馏方法;所以操作I是过滤,过滤时需要的玻璃仪器有玻璃棒、烧杯和漏斗;操作II是蒸馏;
(3)①D中制备的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)为防止空气的成分干扰,最后还应该再用A装置吸收空气的CO2和水,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选置的连接顺序应是:D→C→E→B→A→A;
②A管质量增加66g为二氧化碳的质量,可得碳元素的质量:m(C)=66g×![]() =18g;B管质量增加19.8g是水的质量,可得氢元素的质量:m(H)=19.8g×
=18g;B管质量增加19.8g是水的质量,可得氢元素的质量:m(H)=19.8g×![]() =2.2g;从而可推出含氧元素的质量为:28.2-18-2.2=8g,设最简式为CxHyOz,则x:y:z=
=2.2g;从而可推出含氧元素的质量为:28.2-18-2.2=8g,设最简式为CxHyOz,则x:y:z=![]() :
:![]() :
:![]() =15:22:5,所以物质的最简式为C15H22O5;
=15:22:5,所以物质的最简式为C15H22O5;
④题中该实验方法只能获得有机物的实验式,即可确定最简式的式量,要确定有机物的分子式,还要知道有机物的相对分子质量或摩尔质量,从而知道物质分子中含有的最简式的个数,进而确定物质的分子式;
(4)由于酯不能溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠,结合题意可知,青蒿素中含有酯基,故合理选项是D。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】CO2是一种重要的化工原料,依据题给信息,回答下列问题:
Ⅰ.碳酸钠可利用CO2采用氨碱法生产
(1)碳酸钠可作为碱使用的原因是_____________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4 kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=___________ kJ/mol。
Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2 和1mol/L H2,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 | |||
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c. υ正(H2)=υ逆(H2O) d. c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)某温度下经2min反应达到平衡后c(CO)=0.8mol/L,此温度下的平衡常数为________。
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D