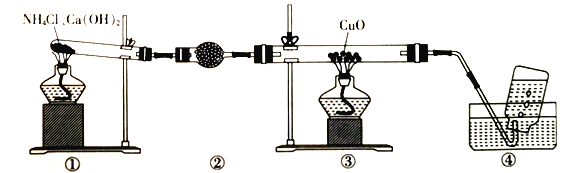
题目内容
【题目】CO2是一种重要的化工原料,依据题给信息,回答下列问题:
Ⅰ.碳酸钠可利用CO2采用氨碱法生产
(1)碳酸钠可作为碱使用的原因是_____________(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4 kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=___________ kJ/mol。
Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2 和1mol/L H2,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 | |||
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c. υ正(H2)=υ逆(H2O) d. c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________℃。
(4)某温度下经2min反应达到平衡后c(CO)=0.8mol/L,此温度下的平衡常数为________。
【答案】CO32-+H2O![]() HCO3-+OH- +135.6 吸热 bc 830 16
HCO3-+OH- +135.6 吸热 bc 830 16
【解析】
I.(1)根据盐的水解规律分析碳酸钠的溶液显碱性的原因;
(2)根据盖斯定律,将①-②×2,整理可得相应反应的热化学方程式;
II.(1)根据表格数据可知:温度升高,化学平衡常数增大,利用平衡常数只与温度有关,利用化学平衡移动原理分析;
(2)该反应混合物都是气体,根据平衡时任何物质的浓度及反应速率不变分析判断;
(3)利用浓度关系,计算化学平衡常数,然后根据温度与平衡常数的关系判断温度;
(4)根据物质的起始浓度与平衡后c(CO)=0.8mol/L,用三段式计算出各种物质的浓度,带入平衡常数表达式,就可以得出该温度下的平衡常数。
(1)碳酸钠是强碱弱酸盐,在溶液中,CO32-发生水解反应,消耗水电离产生的H+,使溶液中c(OH-)>c(H+),水解反应的离子方程式为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2)由盖斯定律可知:反应热与途径无关,只与物质的始态和终态有关,将①-②×2,整理可得相应反应的热化学方程式:2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=+135.6kJ/mol;
II.(1)根据表格数据可知:温度升高,化学平衡常数增大,由于平衡常数只与温度有关,由化学平衡移动原理可知:升高温度,化学平衡向吸热反应方向移动,化学平衡常数增大,说明升高温度,平衡正向移动;
(2) a.由于该反应是反应前后气体体积相等的反应,因此在恒温恒容或恒温恒压的条件下,容器中气体的压强始终不变,故不能据此判断反应是否处于平衡状态,a错误;
b.混合气体中c(CO)不变,说明物质的消耗速率与产生速率相等,反应处于平衡状态,b正确;
c.在任何情况下,υ正(H2)= υ正(H2O),若υ正(H2)=υ逆(H2O),说明υ正(H2O)= υ逆(H2O),反应处于平衡状态,c正确;
d.c(CO2)=c(CO)时,不能说明两者不再发生变化,反应可能处于平衡状态,也可能未处于平衡状态,因此不能据此判断是否处于平衡状态,d错误;
故合理选项是bc;
(3)若某温度下,物质的平衡浓度关系为c(CO2)·c(H2)= c(CO)·c(H2O),则化学平衡常数K=1,根据温度与平衡常数的关系可知反应温度为:830℃;
(4)可逆反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
c起始(mol/L) 1 1 0 0
c改变(mol/L) 0.8 0.8 0.8 0.8
c平衡(mol/L) 0.2 0.2 0.8 0.8
则K=![]() =16。
=16。

【题目】a、b、c、d是短周期元素,在周期表中的相对位置如图所示.d元素原子核外M层电子数是K层电子数的2倍.下列说法中,错误的是( )
a | b | c |
d |
A. 高温下,a单质可与d的氧化物发生置换反应
B. b的气态氢化物可与其最高价含氧酸反应
C. a、b、c 的最高正化合价等于其所在族序数
D. d的氧化物是制作光导纤维的材料