题目内容
【题目】下图是实验室制取SO 2并验证SO 2的某些性质的装置,请回答:
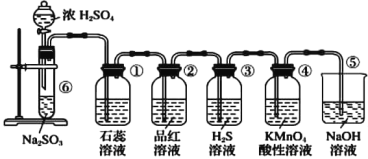
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液__________,此实验证明SO 2具有_________的性质。
(3)②中的品红溶液________。
(4)③中发生的化学反应方程式为________________。
(5)④中的实验现象是______________________,证明SO 2有_____________性。
(6)⑤装置的作用是_________,该反应的离子方程式为________________。
【答案】Na2SO3+H2SO4(浓)= Na2SO4+ SO2↑+ H2O 变红 酸性 褪色 SO2+2H2S=3S↓+2H2O 酸性高锰酸钾褪色 还原性 吸收二氧化硫,防止二氧化硫污染空气 SO2+ 2OH-= SO32-+ H2O
【解析】
装置⑥中浓硫酸与亚硫酸钠反应生成二氧化硫,装置①中石蕊溶液变红可以验证二氧化硫溶于水显酸性;装置②中品红褪色可以验证二氧化硫的漂白性;装置③中产生淡黄色沉淀可以验证二氧化硫的氧化性;装置④中酸性高锰酸钾溶液褪色可以验证二氧化硫的还原性;装置⑤中NaOH溶液可以吸收未反应的二氧化硫。
(1)浓硫酸和亚硫酸钠可以反应生成二氧化硫,方程式为Na2SO3+H2SO4(浓)= Na2SO4+ SO2↑+ H2O;
(2)二氧化硫溶于水生成亚硫酸使溶液显酸性,所以石蕊溶液会变红,证明SO2具有酸性;
(3)二氧化硫可以漂白品红使品红溶液褪色;
(4)二氧化硫可以和硫化氢反应生成硫单质,方程式为SO2+2H2S=3S↓+2H2O;
(4)二氧化硫具有还原性可以使酸性高锰酸钾溶液褪色;
(5)二氧化硫有毒不能直接排放到空气中,可以用NaOH溶液吸收二氧化硫,防止二氧化硫污染空气,离子方程式为SO2+ 2OH-= SO32-+ H2O。