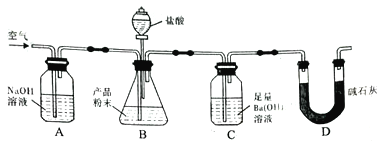
题目内容
【题目】Ⅰ、锌和100 mL稀硫酸反应,小组同学根据实验过程绘制的标准状况下的气体体积V与时间 t的图像如下图所示。
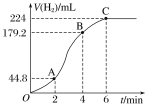
①在OA、AB、BC三段中反应速率最快的是_________,原因是__________________________。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为________________。
③为了减缓反应速率而又不改变产生氢气的量,该同学在硫酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.0.5mol/L盐酸
其中,你认为可行的是(填序号)______________.
Ⅱ、在一个小烧杯里加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g氯化铵晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是______________________________。
(2)“结冰”现象说明该反应断开旧化学键________(填“吸收”或“放出”)的能量________(填“>”或“<”)形成新化学键________(填“吸收”或“放出”)的能量。
【答案】AB 反应放热,使温度升高,反应速率加快 0.03mol·L-1·min-1 AB 使反应物充分混合,迅速发生反应 吸收 > 放出
【解析】
Ⅰ.①分析相同时间内氢气体积的多少来判断速率的快慢;
②利用速率表达式v=△c/△t计算速率;
③为了减缓反应速率而又不改变产生氢气的量,可以将硫酸进行稀释,使其浓度降低;
Ⅱ.(1)玻璃棒的搅拌作用是使混合物混合均匀,让化学反应快速发生;
(2)结冰说明反应吸热,吸热反应中,反应物的总能量小于生成物的总能量,旧键断裂吸收的能量高于新键生成释放的能量。
Ⅰ.①从图中看出2~4min内产生氢气最多,故这段时间内反应速率最大,因为为反应放热,使温度升高,反应速率加快;
②2~4min内,产生氢气179.2mL44.8mL=134.4mL,物质的量为![]() =6×103mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为6×103mol,v(H2SO4)=
=6×103mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为6×103mol,v(H2SO4)=![]() =
= =0.03mol·L-1·min-1;
=0.03mol·L-1·min-1;
③为了减缓反应速率而又不改变产生氢气的量,可以将硫酸进行稀释,使其浓度降低,加入蒸馏水和NaCl溶液都能达到要求,但是不能加入稀盐酸,否则会使产生氢气的量增加;答案选AB;
Ⅱ.(1)Ba(OH)28H2O晶体和氯化铵晶体之间的反应是固体之间的反应,搅拌可使反应物充分混合、迅速发生反应;
(2)结冰说明反应是一个吸热反应,则反应物的总能量小于生成物的总能量,旧键断裂吸收的能量高于新键生成释放的能量。

 综合自测系列答案
综合自测系列答案【题目】a、b、c、d是短周期元素,在周期表中的相对位置如图所示.d元素原子核外M层电子数是K层电子数的2倍.下列说法中,错误的是( )
a | b | c |
d |
A. 高温下,a单质可与d的氧化物发生置换反应
B. b的气态氢化物可与其最高价含氧酸反应
C. a、b、c 的最高正化合价等于其所在族序数
D. d的氧化物是制作光导纤维的材料