题目内容
【题目】硼(B)可形成 H3BO3、NaBH4 、NaBO2等化合物,用途广泛。
(1)H3BO3 为一元弱酸,可由硼砂(Na2B4O7﹒10H2O)与盐酸加热反应制得。该反应的化学方程式为____________________。 常温下 0.1 mol·L-1的H3BO3溶液 pH 约为5.0,则H3BO3的电离常数Ka约为____。
(2)在恒容密闭容器中发生储氢反应:BPO4(s)+4Na(s)+ 2H2(g)![]() Na3PO4(s) + NaBH4(s) ΛH<0
Na3PO4(s) + NaBH4(s) ΛH<0
下图为NaBH4产率与反应温度的关系曲线:
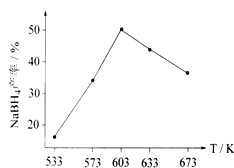
①反应达到平衡时,下列有关叙述正确的是_____。(填标号)
A.生成1mol NaBH4只需1mol BPO4、4mol Na和2 mol H2
B.若向容器内通入少量H2,则v(放氢)< v(吸氢)
C.升高温度,放氢速率加快,重新达到平衡时容器压强增大
D.降低温度,该反应的平衡常数减小
②NaBH4的产率在 603K之前随温度升高而增大的原因是___________________。
(3)NaBH4可水解放出氢气,反应方程式为:NaBH4 + 2H2O=NaBO2 + 4H2↑。
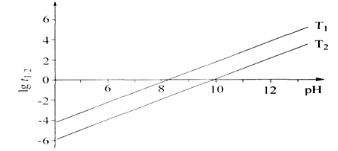
① t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为分钟)。lgt1/2随 pH和温度的变化如图所示。在酸性条件下,NaBH4不能稳定存在,原因是_____(用离子方程式表示);T1__T2。(填“ >” 或“ <”)
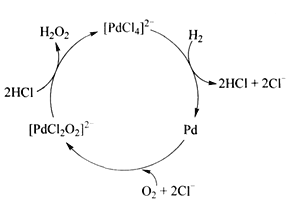
②用H2制备H2O2的一种工艺简单、能耗低的方法, 反应原理如下图所示。总反应的化学方程式为___________。
【答案】Na2B4O7·l0H2O +2HC1![]() 4H3BO3+2NaCl+5H2O 1.0× 10-9 BC 反应未达到平衡状态,温度升高,反应速率加快 BH4- +H++3H2O=H3BO3+4H2↑ < H2+O2
4H3BO3+2NaCl+5H2O 1.0× 10-9 BC 反应未达到平衡状态,温度升高,反应速率加快 BH4- +H++3H2O=H3BO3+4H2↑ < H2+O2 ![]() H2O2
H2O2
【解析】
(1)一元弱酸电离常数为达到平衡时,溶液所电离生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比。
(2)掌握外界条件温度和浓度对化学平衡移动的影响,即可解题。
(3)温度越低,反应越慢,t1/2越大。根据图示分析出pH相同的时候所对应的lgt1/2越大,t1/2越大。
(1)Na2B4O7﹒10H2O与盐酸加热反应生成H3BO3、NaCl和H2O。因此答案为Na2B4O7·l0H2O +2HC1![]() 4H3BO3+2NaCl+5H2O。H3BO3为一元弱酸,电离方程式为H3BO3
4H3BO3+2NaCl+5H2O。H3BO3为一元弱酸,电离方程式为H3BO3![]() H++H2BO3-,根据电离常数的定义可知Ka=
H++H2BO3-,根据电离常数的定义可知Ka=![]() =
=![]() =1.0×10-9。
=1.0×10-9。
(2)①A.该反应为可逆反应,1mol BPO4、4mol Na和2 mol H2不可能完全反应转化为1mol NaBH4,故A错误。
B.若向容器内通入少量H2,增加反应物的浓度,反应向正反应方向进行,则v(放氢)< v(吸氢)。故B正确。
C.升高温度,正逆反应速率都加快,升高温度反应向吸热反应即放氢方向进行,重新达到平衡时容器压强增大,故C正确。
D.该反应为放热反应,温度降低,平衡向正反应方向进行,平衡常数变大,故D错误。本题选BC。
②NaBH4的产率在 603K之前随温度升高而增大是因为反应没有达到平衡状态,温度升高,反应速率加快。
(3)①根据NaBH4水解的化学方程式可知BH4-中H显-1价,和水电离的H+发生氧化还原反应生成H2。在酸性条件下BH4-和H+发生氧化还原反应生成H2,离子方程式为BH4- +H++3H2O=H3BO3+4H2↑。t1/2越大lg t1/2越大,pH相同的时候T1对应的lg t1/2大,也就是T1时水解的半衰期长,反应速率慢,温度低,T1<T2。
②根据图示可知Pd和[PdCl2O2]2-为中间产物,[PdCl4]2-为催化剂,反应的化学方程式为H2+O2![]() H2O2。
H2O2。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案