题目内容
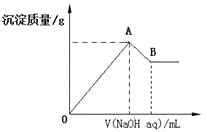
【题目】在含有0.6molCl-、0.8 molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则
A.x=![]()
B.x的取值范围是0<x<11/32
C.A点横坐标的值随x发生变化
D.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
【答案】AB
【解析】
A.Al3+的物质的量为amol,根据电荷守恒:n(Cl-)+2n(SO42-)=2n(Mg2+)+3n(Al3+),解得2n(Mg2+)=0.6mol+1.6mol-3amol=(2.2-3a)mol,n(Mg2+)=(1.1-1.5a)mol,所以Al3+的物质的量与混合溶液中离子总物质的量的比值为x,即x= ![]() =
=![]() ,故A正确;
,故A正确;
B.溶液中Al3+的物质的量为amol,由电荷守恒可知Mg2+的物质的量为(1.1-1.5a)mol,x= ![]() ,a<
,a<![]() ,解得x的取值范围是:0<x<
,解得x的取值范围是:0<x<![]() ,故B正确;
,故B正确;
C.因为溶液中氯离子、硫酸根离子物质的量一定,A点时镁离子、铝离子完全被转化为沉淀,则溶液中的溶质转化为氯化钠、硫酸钠,所以A点横坐标的值不会随x发生变化,故C错误;
D.Al3+的物质的量为amol,最终消耗氢氧化钠是4amol,n(Mg2+)=(1.1-1.5a)mol,消耗氢氧化钠是(2.2-3a)mol,共消耗氢氧化钠是a+2.2mol,所以若B点横坐标为200mL时,c(NaOH)= ![]() mol/L,故D错误;
mol/L,故D错误;
故选:AB。

练习册系列答案
相关题目