题目内容
【题目】下列有关晶体的叙述不正确的是( )
A.氯化钠和氯化铯晶体中,阴离子的配位数均为6
B.金刚石为空间网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
【答案】A
【解析】
A.氯化钠晶体中氯离子的配位数为6,氯化铯晶体中氯离子的配位数为8,则氯化钠和氯化铯晶体中氯离子的配位数不相同,A选项错误;
B.金刚石为空间网状结构,一个碳原子与4个碳原子形成共价键,所以碳原子采取sp3杂化,B选项正确;
C.金属钠的晶体采用体心立方堆积,所以每个晶胞含原子数为![]() ,每个钠原子周围距离最近的钠原子有8个,所以配位数为8,C选项正确;
,每个钠原子周围距离最近的钠原子有8个,所以配位数为8,C选项正确;
D.在干冰晶体中,每个CO2分子周围紧邻的有12个CO2分子,D选项正确;
答案选A。

 口算能手系列答案
口算能手系列答案【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
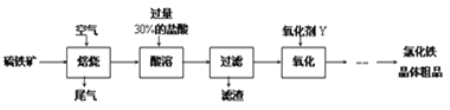
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
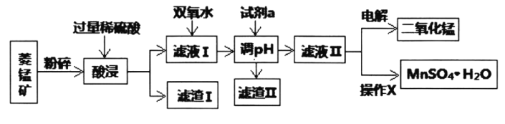
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
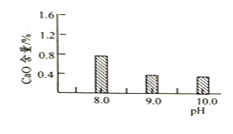
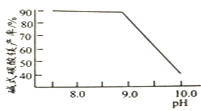
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
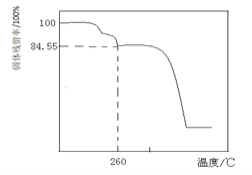
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
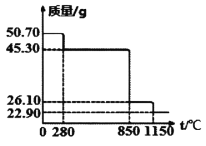
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。