题目内容
7.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化2NO+2CO=N2+2CO2对此反应,下列叙述正确的是( )| A. | 冬天气温低,反应速率降低,对环境污染会更大 | |
| B. | 改变压强对反应速率没有影响 | |
| C. | 使用催化剂能促使反应正向进行 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
分析 A.降低温度可减慢反应速率,NO和CO对人的危害远大于N2和CO2;
B.有气体参见反应,改变压强时,反应速率改变;
C.催化剂能增大活化分子的百分数,反应速率增大;
D.当改变外界条件,活化分子的浓度或百分数发生改变时,化学反应速率改变.
解答 解:A.升高温度,可以加快反应速率,降低温度可减慢反应速率.由于NO和CO对人的危害远大于N2和CO2,所以当NO与CO反应生成N2和CO2的速率降低时,对人危害更大,故A正确;
B.增大压强,可以使气体物质的体积变小,其浓度变大,所以反应速率加快,反之,减小压强,可使气体的体积变大,浓度变小,反应速率变慢,由于该反应是气体物之间的反应,改变压强,对反应速率有影响,故B错误;
C.催化剂可以改变化学反应速率,不影响平衡,即不能使反应正向移动,故C错误;
D.2NO+2CO=N2+2CO2是一个气体物质间的化学反应,改变反应物的浓度、压强、温度均能改变该反应的速率,故D错误.
故选A.
点评 本题考查反应速率的影响,为高频考点,侧重于基本理论的理解和应用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
15.现有下列九种物质:①H2 ②铝 ③Na2O ④CO2⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水⑧稀硝酸⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为2HNO3+Ba(OH)2=Ba(NO3)2+2H2O.
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
2.可逆反应A(g)+B(g)?C(g)+D(g).在一定条件下,说明该反应已达到平衡状态的是( )
| A. | 容器内压强不随时间变化 | B. | A、B、C、D四者共存 | ||
| C. | 消耗A的速率与生成A的速率相等 | D. | D、C的生成速率相等 |
12.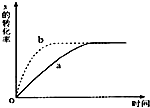 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 缩小体积 | D. | 减小N的投入量 |
16.下列叙述中,不正确的是( )
| A. | 塑料,合成纤维和合成橡胶都是合成材料 | |
| B. | 煤是由有机物和无机物组成的复杂混合物 | |
| C. | 聚乙烯是通过聚反应制得的高分子化合物 | |
| D. | 钠,铝与铁通常都是采用电解法冶铁的 |
17.能正确表示下列反应的离子方程式是( )
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| C. | 实验室制取 Cl2:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H20 | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH${\;}_{4}^{+}$ |
 .
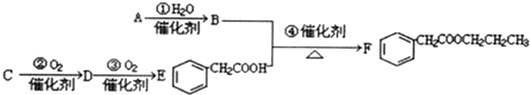
. A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示:
A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平.有关物质的转化关系如图1所示: