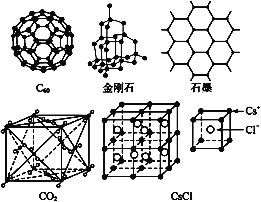
题目内容
【题目】有四种短周期元素,它们的结构、性质等信息如表所述:
元素 | 结构、性质等信息 |
X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质与冷水剧烈反应 |
Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒剂和杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置________;其相对分子质量最小的气态氢化物常用作______。
(2)工业上制取Y单质常用的方法是(用化学方程式表示)_________。
(3)Y离子半径比Z离子的半径________(填“大”或“小”)。
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于________(填“吸热”或“放热”)反应,写出反应的化学方程式为______________。
(5)举出实例说明M的非金属性比X强:_____________。
【答案】第2周期ⅣA族燃料2NaCl(熔融)![]() 2Na+Cl2↑大放热2Al+Fe2O3
2Na+Cl2↑大放热2Al+Fe2O3![]() Al2O3+2Fe稳定性:HCl>CH4或酸性燃料:HClO4>H2CO3(两者答其中一个即可,其他合理答案也可)
Al2O3+2Fe稳定性:HCl>CH4或酸性燃料:HClO4>H2CO3(两者答其中一个即可,其他合理答案也可)
【解析】
X元素是构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体,故X为碳元素;Y是短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质,故Y为Na;Z与Y同周期,其最高价氧化物的水化物呈两性,则Z为Al;M是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,故M为Cl。
构成有机物的核心元素为C元素,短周期中原子半径最大的是Na元素,与钠同周期且最高价氧化物的水化物呈两性的是Al元素,自来水生产过程中常用的消毒剂和杀菌剂是Cl2。(1)碳的氢化物中相对分子质量最小的是甲烷,甲烷常用作燃料。(2)金属钠是活泼金属,常用电解法冶炼,2NaCl(熔融)![]() 2Na+Cl2↑ 。(3)Na+和Al3+具有相同的电子数,但核电荷数Al>Na,故离子半径Na+>Al3+。(4)铝与氧化铁在高温下发生铝热反应,生成铁单质,用于焊接钢轨。方程式为2Al+Fe2O3
2Na+Cl2↑ 。(3)Na+和Al3+具有相同的电子数,但核电荷数Al>Na,故离子半径Na+>Al3+。(4)铝与氧化铁在高温下发生铝热反应,生成铁单质,用于焊接钢轨。方程式为2Al+Fe2O3![]() Al2O3+2Fe ;(5)比较元素非金属性强弱的依据有:比较单质与氢气化合的难易程度,生成氢化物的稳定性,最高价含氧酸的酸性等。
Al2O3+2Fe ;(5)比较元素非金属性强弱的依据有:比较单质与氢气化合的难易程度,生成氢化物的稳定性,最高价含氧酸的酸性等。

【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)达到平衡的时间是________,理由是___________________。
(2)如图中表示NO2的浓度变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内各物质的浓度保持不变
c.v逆(NO)=2v正(O2)
d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂