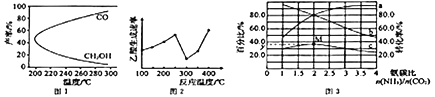
题目内容
【题目】[化学一选修3:物质结构与性质](15 分)
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列问题:
(1) UF4用Mg或Ca 还原可得金属铀。基态钙原子的核外电子排布式为__________________;熔点:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
a.氢键 b.配位键 c.共价键 d.离子键 e.金属键
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空间构型为_____________________,与NH4+互为等电子体的分子或离子有_____(任写两种)。
②CO32-中碳原子的杂化轨道类型为___________________________。
③分解产物中属于非极性分子的是____________________(填选项字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞结构及晶胞参数如图所示:
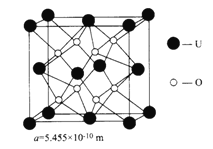
①晶胞中U 的配位数为__________________________。
②UO2晶体的密度为_____________g·cm-3(列出计算式即可。设NA表示阿伏加德罗常数的值)。
【答案】 1s22s22p63s23p64s2(或[Ar]4s2) CaO和MgO均为离子晶体,MgO的晶格能大于CaO 68% abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4 sp2 bc 8 (4×270)/[NA×(5.455×10-8)3]
【解析】(1) CaO和MgO都是由活泼金属与活泼非金属组成的化合物,属于离子化合物,离子晶体的熔点由其晶格能大小决定,MgO的晶格能大于CaO,故熔点:MgO(2852℃)高于CaO(2614℃);钙为20号元素,基态钙原子的核外电子排布式为1s22s22p63s23p64s2或[Ar]4s2;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为68%;(2)NH4HF2中NH4+与HF2-间为离子键,H-N为极性共价键、配位键;HF2-的结构式为[F-H![]() F]-含有氢键结构。答案选abcd;(3)①NH4+中的N为sp3杂化,四个N—H键的键能、键长及键角均相同,空间构型为正四面体;等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4;②CO32-价层电子对数目为
F]-含有氢键结构。答案选abcd;(3)①NH4+中的N为sp3杂化,四个N—H键的键能、键长及键角均相同,空间构型为正四面体;等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或原子团,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4;②CO32-价层电子对数目为![]() =3,碳原子的杂化轨道类型为sp2杂化;③a、NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故a错误;b、CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故b正确;c、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故c错误;d、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故d错误;答案选bc;(4)①由晶胞的面心观察,可知U的配位数为8,O的配位数为4;②晶胞中U为
=3,碳原子的杂化轨道类型为sp2杂化;③a、NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子,故a错误;b、CO2中含有极性键,为直线形分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故b正确;c、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故c错误;d、H2O中含有极性键,为V形分子,但结构不对称,属于极性分子,故d错误;答案选bc;(4)①由晶胞的面心观察,可知U的配位数为8,O的配位数为4;②晶胞中U为![]() ,O为8,立方体体积为
,O为8,立方体体积为![]() ,
,  。
。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案【题目】根据下列实验事实,不能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀 | 醋酸的酸性强于H2SiO3 |
B | 向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成气泡的速率更快 | 催化效果: Fe3+> Cu2+ |
C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动 |
D | 常温下分别测等浓度的醋酸和氨水pH,二者的pH 分别为2和12 | 常温下,醋酸和氨水的电离平衡常数相等 |
A. A B. B C. C D. D