题目内容
【题目】实验室里研究不同价态硫元素之间的转化
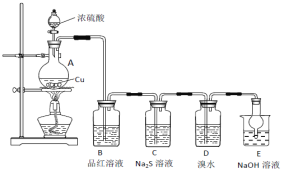
(1)A中发生反应的化学方程式为________________。
(2)B中的现象是__________________。
(3)C中出现淡黄色沉淀,反应中Na2S做 ____________(填“氧化剂”或“还原剂”)。
(4)D溴水褪色,该反应S元素的价态变化是由+4价变为________________价。
(5)某同学认为D中换成H2O2溶液也可以实现上述硫元素的价态转化,并通过实验进一步证明了他的观点。实验方案和现象为:取D中反应后的溶液于试管中,_________。
(6) E的作用是_____________,离子方程式为_________________________。
(7)上述实验体现SO2 的性质有__________________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 品红褪色 还原剂 +6 加入BaCl2溶液,产生白色沉淀 吸收SO2尾气,防止污染环境 SO2+2OH=SO32+H2O 漂白性、氧化性、还原性、酸性氧化物通性
CuSO4+SO2↑+2H2O 品红褪色 还原剂 +6 加入BaCl2溶液,产生白色沉淀 吸收SO2尾气,防止污染环境 SO2+2OH=SO32+H2O 漂白性、氧化性、还原性、酸性氧化物通性
【解析】
该实验的目的是研究不同价态硫元素之间的转化,A为SO2的发生装置,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4 +SO2↑+2H2O,B为检验SO2的装置,SO2有漂白性,可用品红溶液检验,现象是品红褪色,C中Na2S和SO2发生氧化还原反应生S沉淀,说明SO2有氧化性,D中SO2和溴水反应生成H2SO4和氢溴酸,通过检验SO42-的存在,验证SO2有还原性,SO2是污染性气体,是酸性氧化物,所以E装置中盛装NaOH溶液,目的是吸收多余SO2,据此分析解答。
CuSO4 +SO2↑+2H2O,B为检验SO2的装置,SO2有漂白性,可用品红溶液检验,现象是品红褪色,C中Na2S和SO2发生氧化还原反应生S沉淀,说明SO2有氧化性,D中SO2和溴水反应生成H2SO4和氢溴酸,通过检验SO42-的存在,验证SO2有还原性,SO2是污染性气体,是酸性氧化物,所以E装置中盛装NaOH溶液,目的是吸收多余SO2,据此分析解答。
(1)A装置中Cu和浓硫酸加热条件下反应,生成硫酸铜、二氧化硫和水,化学方程式为Cu+2H2SO4(浓)![]() CuSO4 +SO2↑+2H2O;
CuSO4 +SO2↑+2H2O;
(2)B装置为检验SO2的装置,SO2有漂白性,能使品红褪色,所以B装置中现象是品红溶液褪色;
(3)C装置中,Na2S和SO2发生反应2Na2S+3SO2=3S↓+2Na2SO3,可观察到有淡黄色沉淀(或浑浊)生成,该反应中的Na2S:S的化合价由2价升为0价,Na2S发生氧化反应、作还原剂,SO2发生还原反应、作氧化剂;
(4)D装置中,Br2和SO2发生反应Br2+SO2+2H2O=2HBr +H2SO4,S由+4价变为+6价;
(5)过氧化氢溶液具有氧化性,会将二氧化硫氧化成硫酸,要想证明硫元素的价态转化,只需要证明产物中有SO42即可,所以只需要取D中溶液于试管中,加入盐酸酸化的BaCl2溶液即可,实验现象是有白色沉淀生成;
(6)SO2是污染性气体,需要尾气处理,E装置的作用是吸收SO2尾气,防止污染环境;SO2是酸性氧化物,与NaOH溶液反应的离子方程式为SO2+2OH=SO32+H2O;
(7)B装置中褪色现象体现SO2的漂白性,C装置中出现浑浊现象体现SO2的氧化性,D装置中溴水褪色体现SO2的还原性,E装置中反应体现酸性氧化物的通性。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案