题目内容
【题目】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
【答案】B
【解析】
微粒的浓度越大,lgc越大。酸性溶液中c(CH3COOH)≈0.01mol/L,lgc(CH3COOH)≈-2,碱性溶液中c(CH3COO-)≈0.01mol/L,lgc(CH3COO-)≈-2;酸性越强lgc(H+)越大、lgc(OH-)越小,碱性越强lgc(H+)越小、lgc(OH-)越大,根据图象知,曲线c为CH3COOH,a为CH3COO-,b线表示H+,d线表示OH-。据此分析解答。
A. 根据上述分析,直线b、d分别对应H+、OH-,故A正确;
B. 根据图象,pH=6时,c(Ac-)>c(HAc)>c(H+),故B错误;
C. HAc电离常数Ka=![]() ,当c(CH3COOH)=c(CH3COO-),Ka=c(H+)=10-4.74,数量级为10-5,故C正确;
,当c(CH3COOH)=c(CH3COO-),Ka=c(H+)=10-4.74,数量级为10-5,故C正确;
D. 曲线a与c的交点,表示c(CH3COOH)=c(CH3COO-),根据C的分析,Ka=c(H+)=10-4.74,pKa=-lgKa=-lg c(H+)=pH=4.74,故D正确;
答案选B。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
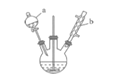
小博士期末闯关100分系列答案【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。
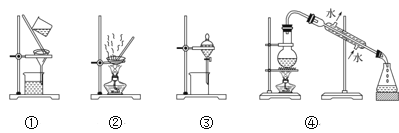
(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。




