题目内容
【题目】周期表前四周期的元素 a、b、c、d、e,原子序数依次增大。a 的核外电子总数与其周期数相同,b 的价电子层中的未成对电子有 3 个,c 的最外层电子数为其内层电子数的 3 倍,d 与 c 同族;e 的基态原子的价电子数是其 N 层电子数的4 倍。回答下列问题:
(1)a 的基态原子核外电子运动的轨道呈_____形。
(2)b 的基态原子的核外电子占据_____个原子轨道。
(3)c 的价电子轨道表示式为_____。
(4)b 与 c 的第一电离能相比,较大的是_________(填元素符号),理由是_____。
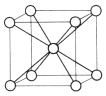
(5)e 的晶体在一定温度下的晶胞结构如图,其一个晶胞的质量为_________g(用含 NA 的式子表示),晶体中空间利用率为_______(用 含 π 的式子表示)。
【答案】球 5 ![]() N N的外围电子排布为2s22p3,p轨道处于半充满状态,比较稳定,较难失电子,故第一电离能较大
N N的外围电子排布为2s22p3,p轨道处于半充满状态,比较稳定,较难失电子,故第一电离能较大 ![]() (或
(或![]() )
) ![]()
【解析】
周期表前四周期的元素 a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,a为H元素;b 的价电子层中的未成对电子有3个,b为N元素;c的最外层电子数为其内层电子数的3倍,d与c同族,c是O元素,d是S元素;e的基态原子的价电子数是其N层电子数的4倍,e是Fe元素。
(1)a为H元素,电子去呈球形,H的基态原子核外电子运动的轨道呈球形。
(2)b为N元素,N的基态原子的核外电子排布式为1s22s22p3,N的基态原子的核外电子占据1+1+3=5个原子轨道。
(3)c为O元素,c的价电子轨道表示式为![]() 。
。
(4)N与O的第一电离能相比,较大的是N(填元素符号),理由是N的外围电子排布为2s22p3,p轨道处于半充满状态,比较稳定,较难失电子,故第一电离能较大。
(5)根据晶胞结构,每个晶胞中含Fe原子个数为8×1/8+1=2,其一个晶胞的质量为![]() (或
(或![]() );设Fe的原子半径为r,Fe晶胞中处于体对角线上的原子相邻,体对角线长度为晶胞棱长的
);设Fe的原子半径为r,Fe晶胞中处于体对角线上的原子相邻,体对角线长度为晶胞棱长的![]() 倍,则晶胞边长=
倍,则晶胞边长=![]() ,空间利用率为
,空间利用率为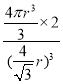 =
=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案