题目内容
m g铜和足量的浓硫酸反应,生成SO2 n L,则被还原的硫酸是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:被还原的硫酸生成SO2,由Cu的物质的量,根据电子转移守恒计算n被还原(硫酸),再根据m=nM计算被还原硫酸的质量,注意二氧化硫不一定处于标准状况,不能根据体积计算被还原硫酸的物质的量.
解答:
解:mg Cu的物质的量=
=
mol,根据电子转移守恒:n被还原(硫酸)=
=
mol,故被还原硫酸的质量=
mol×98g/mol=
g,二氧化硫不一定处于标准状况,不能根据体积计算被还原硫酸的物质的量,故选C.
| mg |
| 64g/mol |
| m |
| 64 |
| ||
| 6-4 |
| m |
| 64 |
| m |
| 64 |
| 49m |
| 32 |
点评:本题考查氧化还原反应,难度中等,A选项为易错点,学生容易忽略二氧化硫是否处于标况下.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
下列物质属于强电解质且能导电的是( )
(1)氯化钠溶液;(2)氯化铵固体;(3)铜;(4)石墨;(5)熔融NaOH;(6)稀硫酸;(7)醋酸.
(1)氯化钠溶液;(2)氯化铵固体;(3)铜;(4)石墨;(5)熔融NaOH;(6)稀硫酸;(7)醋酸.
| A、(1)(2)(5)(6) |
| B、(5) |
| C、(2)(5)(7) |
| D、(1)(3)(4)(5)(6) |
设NA为阿伏伽德罗常数,下列有关叙述中正确的是( )
| A、标准状况下,2.24L Cl2完全溶于水,反应中转移的电子数为0.1NA |
| B、标准状况下,1.12L CCl4中含有的C-Cl键的数目大于0.2NA |
| C、某密闭容器中装有23g NO2气体,则含有的原子数小于1.5NA |
| D、58.5g的氯化钠固体中含氯化钠分子数为NA |
新弹性材料丁基苯呲橡胶的结构简式如图.

其单体可能是以下物质中的某几种正确的一组单体是( )
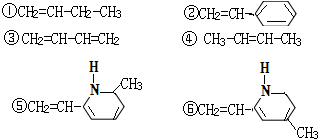

其单体可能是以下物质中的某几种正确的一组单体是( )

| A、①②⑥ | B、②③⑤ |
| C、①②⑤ | D、②④⑥ |
代表有机物中几种同系物的相对分子质量的一组数字是( )
| A、16、32、48、64 |
| B、2、16、30、44、58 |
| C、16、17、18、19 |
| D、46、60、74、88、102 |
下列有关物质的性质、应用或制取的说法正确的是( )
| A、工业上将氯气通入澄清石灰水中,制取漂白粉 |
| B、除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤 |
| C、自来水厂可用明矾对水进行消毒杀菌 |
| D、常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 |
下列离子方程式正确的是( )
| A、澄清石灰水加入稀盐酸 Ca(OH)2+2H+=Ca2++2H2O |
| B、钠与水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、铜插入硝酸银溶液 Cu+Ag+=Cu2++Ag |
| D、大理石溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ?mol-1,下列叙述正确的是( )
| A、平衡后减小压强,混合气体平均摩尔质量增大 | ||
B、平衡时v正(O2)=
| ||
| C、4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ | ||
| D、平衡后升高温度,混合气体中NO含量降低 |
在1s、2px、2py、2pz轨道中,具有球对称性的是( )
| A、1s |
| B、2px |
| C、2py |
| D、2pz |