题目内容
【题目】如图为配制480 mL 0.2 mol·L-1 NaCl溶液的示意图。

回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是________(填字母)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
D.溶解过程中,要等烧杯中溶液冷却到室温再转入容量瓶
(2)①中应称NaCl________ g;②选择容量瓶的规格____________。
(3)玻璃棒在②、③两步中的作用分别是____________________________、____________________________。
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第①步称量时物品和砝码放反了 ________。
B.某同学在第⑧步观察液面时仰视________;
【答案】BC 5.9 500mL 搅拌加速溶解 引流 偏低 偏低
【解析】
(1)容量瓶在使用前必须查漏;容量瓶是比较精密的仪器,不能受热,不能直接把试剂放入容量瓶内进行配制,溶解后溶液要冷却到室温再进行转移,据此分析;
(2)根据溶质的质量m=nM=cvM计算;
(3)溶解固体时搅拌是加速溶解,过滤时是引流作用;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=n/V分析对所配溶液的浓度影响。
(1)A.使用容量瓶前应该检查是否漏水,故A正确;
B.容量瓶用水洗净后,不能用待配溶液洗涤,否则会影响配制溶液的浓度,故B错误;
C.配制溶液时,如果试样是固体,应该在烧杯中溶解,当药品完全溶解后,恢复至室温,再把溶液小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线,不能把称好的固体用纸条倒入容量瓶中,故C错误;
D.溶解过程中,要等烧杯中溶液冷却到室温再转入容量瓶,否则会导致所配溶液浓度偏大,故D正确;
综上所述,本题选BC。
(2)①配制480 mL 0.2 mol·L-1 NaCl溶液,需要选用500 mL容量瓶,称NaCl质量为0.5×0.2×58.5≈ 5.9 g;综上所述,本题答案是:5.9。
②配制480 mL 0.2 mol·L-1 NaCl溶液,需要选用500 mL容量瓶;综上所述,本题答案是:500mL。
(3) ②步中,玻璃棒在溶解固体时为了加速溶解,起搅拌作用,③步中,过滤时是起引流作用;综上所述,本题答案是:搅拌加速溶解, 引流。
(4)A.在步骤①中,药品放在右盘,砝码放在左盘(使用游码),则所称量的药品的质量偏小,浓度偏低;因此,本题正确答案是:偏低;
B.步骤⑧中,观察液面时仰视,溶液的体积偏大,所得溶液浓度偏低;因此,本题正确答案是:偏低;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】废旧电池若不进行回收利用,将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料[由Ni(OH)2、碳粉、Fe2O3等涂覆在铝箔上制成]进行回收研究,设计实验流程如下图所示:
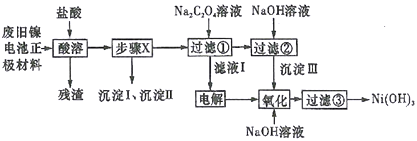
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2能氧化Ni2+为Ni3+;
②NiO+2HCl=NiCl2+H2O;
③Fe3+、Al3+、Ni3+以氢氧化物形式沉淀时溶液的pH如下表所示:
离子 | Fe3+ | Al3+ | Ni2+ |
开始沉淀时的pH | 1.5 | 3.5 | 7.0 |
完全沉淀时的pH | 3.2 | 4.8 | 9.0 |
④Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
请回答下列问题:
(1)酸溶后所留残渣的主要成份__________(填物质名称)。
(2)步骤X的操作为用NiO调节溶液pH,首先析出的沉淀Ⅰ是__________(填化学式),调节过程中pH不能低于___________。
(3)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则加入Na2C2O4溶液后析出的沉淀是__________。
(4)写出生成沉淀Ⅲ的离子方程式__________,该反应的平衡常数为__________。
(5)用化学反应方程式表示沉淀Ⅲ转化为Ni(OH)3________________________。
(6)过滤③后如何检验Ni(OH)3已洗涤干净____________________________。