题目内容
16.氮、磷等化合物在生产、生活中有重要的用途.回答下列问题:I.尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.
请回答下列问题:
(1)尿素[CO(NH2)2]为无色或白色针状,熔点为132.7℃,溶于水、醇,不溶于氯仿等有机溶剂,则尿素属于分子晶体.
(2)写出铁(Ⅲ)电子排布式1s22s22p63s23p63d5或[Ar]3d5
(3)三硝酸六尿素合铁(Ⅲ)中的NO3-空间构型是平面三角形.
Ⅱ.NH3能与许多金属离子形成形成配离子.
(4)下列有关NH3的说法正确的是A.
A. 电负性顺序:N>H
B. 氮的非金属性比磷强,所以熔点:PH3<NH3
C. NH3极易溶于水,是因为氨分子之间易形成氢键
D. NH3分子中H原子的1s轨道与N原子的2p轨道重叠形成3个N-H 键.
(5)1mol配位化合物[Ag(NH3)2]Cl中,含有的σ键数目8NA.
Ⅲ.直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵,阻燃剂聚磷酸铵结构如图.

(6)P原子采取sp3杂化.
(7)聚磷酸铵内存在的作用力有ABC.
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力.
分析 (1)分子晶体熔融时,共价键不会被破坏,所以熔点低,据此判断;
(2)铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成Fe3+,再根据核外电子排布规律进行书写;
(3)根据价层电子对互斥理论确定微粒空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;
(4)A.得电子能力越强,电负性越大;B.NH3含有氢键,熔点高,PH3不含氢键;C.NH3极易溶于水,是因为氨分子和水分子之间能形成氢键;
D.NH3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,中心原子是sp3杂化;
(5)配合物[Ag(NH3)2]Cl中,银离子与氨分子之间有2个配位键,NH3中含有3个N-H键,均为σ键;
(6)根据价层电子对互斥理论分析,直链聚磷酸中P原子最外层5个电子,四个与氧原子成σ键,1个与氧原子成π键,无孤对电子,P原子sp3杂化;
(7)离子化合物中存在离子键,非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,分子内或分子之间存在氢键.
解答 解:(1)分子晶体是由分子通过分子间作用力结合形成,熔融时,共价键不会被破坏,熔点低,尿素[CO(NH2)2]为无色或白色针状,熔点为132.7℃,熔点低,属于分子晶体,
故答案为:分子;
(2)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,铁(Ⅲ)为铁原子失去最外层4s能级2个电子,然后失去3d能级上的1个电子形成,核外电子排布式为:1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d5或[Ar]3d5;
(3)NO3-中N原子的价层电子对个数=σ键个数+孤电子对个数=$\frac{5+1}{2}$+0=3,没有孤电子对,所以NO3-的空间构型为平面三角形,
故答案为:平面三角形;
(4)A.得电子能力N>H,所以元素的电负性N>H,故A正确;
B.氮的非金属性比磷强,但熔点:PH3<NH3,是因为NH3含有氢键,而PH3不含氢键,故B错误;
C.N、O的电负性强,分子之间形成氢键,NH3极易溶于水,是因为氨分子和水分子之间能形成氢键,故C错误;
D.NH3中心原子是sp3杂化,sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组新轨道,是由1个s轨道和3个p轨道杂化,形成能量相等的四个sp3杂化轨道,故D错误;
故答案为:A;
(5)配合物[Ag(NH3)2]Cl中,银离子与氨分子之间有2个配位键,每个氨分子中有3个共价键,所以1mol该配合物中含有σ键数目为8×6.02×1023个,即8NA,
故答案为:8NA;
(6)直链聚磷酸中P原子最外层5个电子,四个与氧原子成σ键,1个与氧原子成π键,价层电子对个数=σ键个数+孤电子对个数=4+$\frac{1}{2}$(5-5×1)=4,无孤对电子,所以P原子sp3杂化,
故答案为:sp3;
(7)聚磷酸铵是离子化合物,聚磷酸铵中磷酸根与铵根之间存在离子键,铵根离子中氮、氢存在共价键,铵根离子是由NH3和H+以配位键结合而成,存在配位键,氢键、范德华力存在于分子晶体,该晶体为离子晶体,无氢键、范德华力,
故答案为:ABC.
点评 本题主要考查了晶体的性质、原子核外电子排布、杂化方式、离子的化学键类型等知识,熟练掌握杂化理论应用是解答的关键,题目难度中等.

| A. | 催化转化器中的铂催化剂可加快CO的氧化 | |
| B. | 铂表面做成蜂窝状更有利于提高催化效果 | |
| C. | 在铂催化下,NO、NO2可被CO还原成N2 | |
| D. | 碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O |
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:
CO2 (g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3 kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低
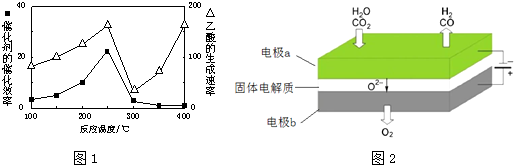
②为了提高该反应中CH4的转化率,可以采取的措施是增大体积减小压强或增大CO2的浓度
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2高温电解技术能高效实现反应A,工作原理示意图2如下:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(2)元素⑨的原子核外次外层电子数为14个.焊接钢轨时,常利用元素⑨的氧化物与⑦的单质在高温下发生反应,写出其中一种反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(3)④、⑤两元素原子第一电离能较大的是N,两元素以质量比7:12组成的化合物A是一种高效火箭推进剂,相对分子质量为152,A的分子式为N4O6.
(4)⑥和⑧可形成某离子化合物,图1所示结构不能(选填“能”或“不能”)表示该离子化合物的晶胞;图1所示结构中,X离子的堆积方式为ABCABC…(选填“ABAB…”或“ABCABC…”).
(5)元素⑩单质的晶胞如图2所示,该晶胞中金属原子的配位数为12,每个晶胞“实际”拥有的原子数是4.

已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②上表中K1>K2(填“>”、“=”或“<”).
(3)如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图.
①下列说法正确的是ABD(填序号).
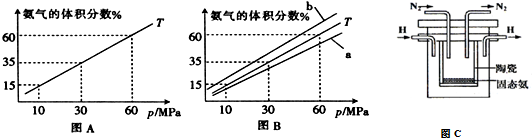
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2)=3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为32.61%.
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式N2+6e-+6H+=2NH3.
(5)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是BD.
A.25℃时,饱和Mg(OH)2溶液中c(OH-)大于饱和MgF2溶液中c(F-)
B.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L-1,则溶液的pH=9
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2.
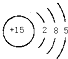
Ⅰ.用Ⅰ1、Ⅰ2、Ⅰ3、Ⅰ4表示钪的电离能,其数据如图1.
(1)与钪同周期且含有相同未成对电子数的非金属元素为Br(填元素符号).
(2)$\frac{{I}_{2}}{{I}_{1}}$<$\frac{{I}_{4}}{{I}_{3}}$(填“>”或“<”).
(3)氯化钠晶体熔点高于氯化钾,其原因为钠离子半径小于钾离子,氯化钠晶格能大于氯化钾,所以氯化钠熔点高.
Ⅱ.提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为2种.
(6)Sc2(C2O4)3•6H2O从583K加热到873K,断裂的化学键类型为离子键、共价键.
 ;
;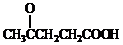 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):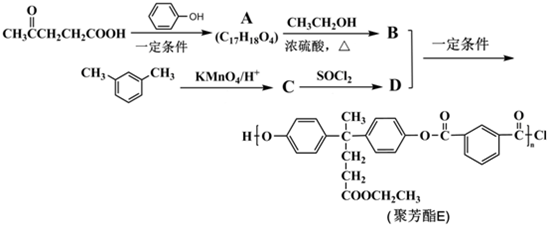
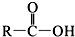 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl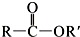 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)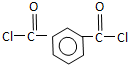 .
.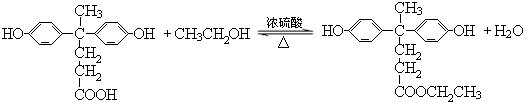 ,.
,.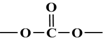 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
.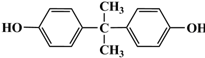 的路线.
的路线.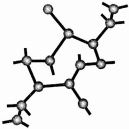 氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示:
氮化硅是一种新型无机非金属材料,主要有α-氮化硅和β-氮化硅两种晶型,它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构,β-氮化硅的结构如图所示: ,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.
,若去掉氢原子后的剩余部分即Si44-(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为Si3O96-.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是SiO2.