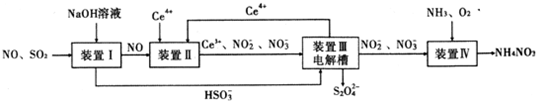
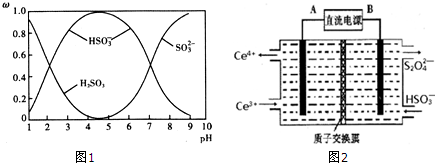
题目内容
19.在短周期元素中,A元素M电子层上有7个电子,C元素与A元素同主族,B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子.(1)画出B元素的原子结构示意图
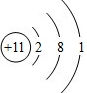 .
.(2)C、B两元素形成化合物的化学式是NaF,其形成过程用电子式表示为
 .
.(3)写出B的两种氧化物的电子式:
 、
、
(4)比较A元素的氢化物与C元素的氢化物稳定性:HF>HCl(填化学式及“<或﹦)原因为:非金属性F>Cl.
分析 A元素原子M层电子层上有7个电子,所以第一和第二层已经排满,则A为氯元素;C元素与A元素同主族,则C为F元素;
B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子,所以B的原子序数为11,为Na元素,据此结合元素周期律知识进行解答.
解答 解:A元素原子M层电子层上有7个电子,所以第一和第二层已经排满,则A为氯元素;C元素与A元素同主族,则C为F元素;B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子,所以B的原子序数为11,为Na元素,
(1)B为Na,钠原子的核电荷数为11,核外电子总数为11,最外层为1个电子,其原子结构示意图为: ,
,
故答案为: ;
;
(2)C、B两元素形成化合物为氟化钠,其化学式为NaF;氟化钠为离子化合物,用电子式表示氟化钠的形成过程为: ,
,
故答案为: ;
;
(3)B为Na元素,其氧化物为氧化钠和过氧化钠,二者都是离子化合物,其电子式分别为: 、
、 ,
,
故答案为: 、
、 ;
;
(4)A元素的氢化物为HCl,C元素的氢化物为HF,非金属性越强,对应的氢化物越稳定,则二者稳定性为:HF>HCl,
故答案为:HF>HCl;非金属性F>Cl.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,熟练掌握原子结构与元素周期律、元素周期表的结构为解答关键,注意明确常见化学用语的概念及书写原则,(3)中电子式的书写为易错点,注意明确氧化钠和过氧化钠电子式的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A. | K+、Na+、CO32-、NO3- | B. | NH4+、Al3+、SO42-、NO3- | ||
| C. | NH4+、K+、MnO4-、SO42- | D. | Ca2+、Na+、NO3-、HSO3- |
14.下列化学用语的书写,正确的是( )
| A. | 氯原子的结构示意图: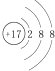 | |
| B. | 6个质子8个中子的碳元素的核素符号:12C | |
| C. | 氯化镁的电子式:[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]-Mg2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 用电子式表示氯化氢的形成过程:H•+•$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- |
9.下列说法正确的是( )
| A. | 绿色化学是指利用化学原理对已产生的环境污染进行治理 | |
| B. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 今年,来自德国、加拿大和我国复旦、清华大学的研究人员通过紧密合作,成功制备出了含+9铱元素的离子(${IrO}_{n}^{+}$),在这种离子中n=8 | |
| D. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用STM技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 |
10.在化学学习中,类推思维是化学学习中常用的一种思维方法.下列类推正确的是( )
| 已知 | 类推 | |
| A | 离子是带电荷的粒子 | 带电荷的粒子一定是离子 |
| B | 稀硫酸作电解质溶液时,氢氧燃料电池的负极反应为 2H2-4e-=4H+ | 氢氧化钾溶液作电解质溶液时,氢氧燃料电池的负极反应为2H2-3e-+4OH-=4H2O |
| C | 将Fe加入到CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| D | 原电池中通常是活泼金属做负极,不活泼金属做正极 | 铜和铝与浓硝酸构成原电池时,铜是正极 |
| A. | A | B. | B | C. | C | D. | D |
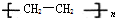 (塑料)、
(塑料)、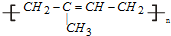 (橡胶).
(橡胶).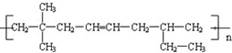 的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3.
的单体为CH2=C(CH3)2、CH2=CH-CH=CH2、CH2=CHCH2CH3. .
. 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请回答下列问题: