题目内容
18.根据反应物和生成物的类别及反应前后物质种类的多少把化学反应分为化合反应、分解反应、置换反应和复分解反应.根据反应中是否有化合价的升降把化学反应分为氧化还原反应和非氧化还原反应;在四种基本类型的反应中置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;氧化还原反应的特征是化合价升降,氧化还原反应的本质是电子转移(得失或者偏移).分析 四种基本反应类型包括化合反应、分解反应、置换反应、复分解反应,含元素化合价变化的反应为氧化还原反应,置换反应中一定含元素的化合价变化,复分解反应中一定不含元素的化合价变化,氧化还原反应的本质为电子转移,其特征为化合价升降,以此来解答.
解答 解:根据反应物和生成物的类别及反应前后物质种类的多少把化学反应分为化合反应、分解反应、置换反应和复分解反应.根据反应中是否有化合价的升降把化学反应分为氧化还原反应和非氧化还原反应;在四种基本类型的反应中置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;氧化还原反应的特征是化合价升降,氧化还原反应的本质是电子转移(得失或者偏移),
故答案为:化合反应;分解反应;置换反应;复分解反应;氧化还原反应;非氧化还原反应;置换反应;复分解反应;化合价升降;电子转移(得失或者偏移).
点评 本题考查氧化还原反应及四种基本反应,为高频考点,把握反应分类及依据为解答的关键,注意四种基本反应类型与氧化还原反应的关系,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
9.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 铜片上发生了还原反应 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 正极有O2逸出 | |
| D. | 正极附近的SO42-离子浓度逐渐增大 |
13.对于在同一容器中进行的反应C+O2═CO2,下列说法不正确的是( )
| A. | 将碳块磨成粉末可以加快反应速率 | |
| B. | 升高温度一般可以加快反应速率 | |
| C. | 容器体积不变时,向其中充入N2,反应速率不变 | |
| D. | 增加碳的量可以加快反应速率 |
12.下列热化学方程式或叙述正确的是( )
| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1, 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
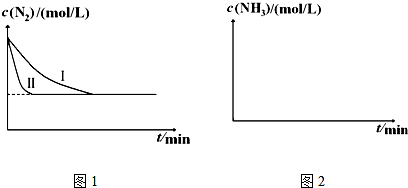
 ;肼含有的化学键的种类与过氧化氢中完全一样,由此可以推论肼的结构式为
;肼含有的化学键的种类与过氧化氢中完全一样,由此可以推论肼的结构式为 .
.