题目内容
12.下列热化学方程式或叙述正确的是( )| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1, 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
分析 A、放热反应的反应热为负值;
B、12g石墨的物质的量为1mol;
C、根据盖斯定律来分析;
D、合成氨的反应为可逆反应,不能进行彻底.
解答 解:A、放热反应的反应热为负值,故A错误;
B、12g石墨的物质的量为1mol,故热化学方程式应为:2C(石墨,s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,故B错误;
C、根据盖斯定律可知:反应热与计量数成正比,且氢气的燃烧放热,则水的分解为吸热,故C正确;
D、合成氨的反应为可逆反应,不能进行彻底,故在一定条件下向密闭容器中充入 0.5 mol N2(g)和1.5 mol H2(g)充分反应放出的热量小于46.2 kJ,故D错误.
故选C.
点评 本题考查了热化学方程式的书写,应注意反应热与计量数成比例,且放热反应的反应热为负值,吸热反应的反应热为正值.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.在下列各说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 酸碱中和时放出的热叫做中和热 | |
| D. | 1mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
20.在容积相同的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol HI(a>b),可逆反应2HI(g)?H2(g)+I2(g)达到平衡后,下列说法正确的是( )
| A. | 开始时A容器中的反应速率大于B容器中的反应速率 | |
| B. | 平衡时c(I2)A=c(I2)B | |
| C. | HI的平衡分解率:αA>αB | |
| D. | 平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器 |
17.在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放热72.65kJ,下列热化学方程式正确的是( )
| A. | CH3OH (l)+$\frac{3}{2}$O2 (g)═CO2(g)+2H2O(l)△H=+726.5 kJ/mol | |
| B. | 2CH3OH (l)+3O2 (g)═2CO2(g)+4H2O(g)△H=+1453 kJ/mol | |
| C. | CH3OH (l)+$\frac{3}{2}$O2 (g)═CO2(g)+2H2O(l)△H=-726.5 kJ/mol | |
| D. | 2CH3OH (l)+3O2 (g)═2CO2(g)+4H2O(g)△H=-1453 kJ/mol |
4.铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多重要的化合物及其化学反应.
如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ•mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ•mol-1
则△H=-150.8kJ•mol-1.
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中H2O的平衡转化率为33.3%(结果保留一位小数).
②下列说法正确的是BC (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是B>C>A(用A、B、C表示).
如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ•mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ•mol-1
则△H=-150.8kJ•mol-1.
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是BC (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
1. 有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )
有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )
 有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )
有一种甲醇质子交换膜燃料电池,电池的结构示意图如图,则下列有关说法不正确的是( )| A. | 电极c是电池的负极 | |
| B. | 每消耗1mol甲醇转移的电子数为3NA | |
| C. | 电极d的反应式为:4H++O2+4e-=2H2O | |
| D. | 电极c的反应式为:CH3OH+H2O-6e-=CO2+6H+ |
2.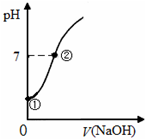 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HClO的电离平衡 | |
| B. | ①到②水的电离程度逐渐减小 | |
| C. | I-能在②点所示溶液中存在 | |
| D. | ②点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |