题目内容
10.某同学作业中有一个离子方程式:RO3x+2R2-+6H+=3R+3H2O.其中RO3x所带电荷x模糊不清.推断RO3x中R元素的化合价是( )| A. | -2 | B. | +2 | C. | +4 | D. | +6 |
分析 氧化还原反应的离子反应方程式中要遵循原子守恒、电荷守恒,根据电荷守恒知,x+2×(-2)+6×(+1)=0,所以x=-2,根据离子中各元素化合价的代数和与其所带电荷相等计算R元素化合价.
解答 解:氧化还原反应的离子反应方程式中要遵循原子守恒、电荷守恒,根据电荷守恒知,x+2×(-2)+6×(+1)=0,所以x=-2,RO32-中R元素的化合价=-2-(-2)×3=+4,故选C.
点评 本题考查氧化还原反应、元素化合价判断等知识点,为高频考点,侧重考查学生分析判断能力,明确离子中各元素化合价代数和与离子所带电荷关系、氧化还原反应离子方程式特点是解本题关键,题目难度不大.

练习册系列答案
相关题目
20.下列物质属于同位素的是( )
| A. | H2O和H2O2 | B. | 11H、21H、31H | C. | O2与O3 | D. | 11H2和21D2 |
1.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )
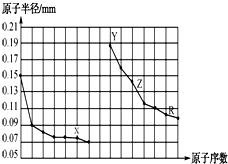

| A. | 同周期非金属元素中,X氢化物的沸点最高 | |
| B. | Y、Z的单质在空气中加热,均可发生燃烧反应 | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
5.下表为元素周期表的一部分.请参照元素①一⑧在表中的位置.回答下列问题:(回答问题时,均需使用元素的真实元素符号,不得使用数字编号)
(1)②⑤⑥的原子半径由大到小的顺序为Na>Al>C.
(2)写出由①②两元素组成,且①的质量分数最高的分子的电子式为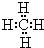 ,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.
,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.
(3)元素③的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式:N2O5+2OH-═2NO3-+H2O.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)写出由①②两元素组成,且①的质量分数最高的分子的电子式为
 ,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.
,写出该化合物跟⑧的单质发生置换反应的化学方程式:CH4+2Cl2 $\frac{\underline{\;一定条件\;}}{\;}$C+4HCl.(3)元素③的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式:N2O5+2OH-═2NO3-+H2O.
15.1100℃时,在容积为2L的密闭容器中,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,该反应的平衡常数为2,按不同方式投入反应物,保持恒温恒容,测得反应达到平衡时有关数据如下:
下列说法正确的是( )
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
| CO的浓度/mol•L-1 | c1 | c2 |
| CO2 的体积分数 | V1 | V2 |
| 体系的压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
| A. | 2c1=3c2 | B. | V1=V2 | C. | p1=p2 | D. | α1=α2 |
6.相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g)
△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )
△H=-197kJ•mol-l.实验测得起始、平衡时的有关数据如下表:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO2 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q2 |
| A. | Q1>Q3>Q2=78.8kJ | |
| B. | 三个容器中反应的平衡常数不相等 | |
| C. | 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% | |
| D. | 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=$\frac{1}{5t}$ mol/(L•min) |
3.在下列各说法中,正确的是( )
| A. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 酸碱中和时放出的热叫做中和热 | |
| D. | 1mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
4.铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多重要的化合物及其化学反应.
如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ•mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ•mol-1
则△H=-150.8kJ•mol-1.
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中H2O的平衡转化率为33.3%(结果保留一位小数).
②下列说法正确的是BC (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是B>C>A(用A、B、C表示).
如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ•mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ•mol-1
则△H=-150.8kJ•mol-1.
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是BC (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |