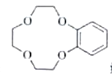
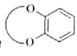
题目内容
【题目】砷(As)是第四周期第ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)工业上用砷废渣制H3AsO4的反应为:2As2S3+5O2+6H2O=4H3AsO4+6S,通常将含砷废渣(主要成分为As2S3)制成浆状,加压通O2氧化。分别分析“制成浆状”、“ 加压通O2”对该反应的影响___________________。
(2)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s) △H1
H2(g)+2O2(g)=H3AsO4(s) △H1
2As(s)+O2(g)=As2O5(s) △H2
H2(g)+ ![]() O2(g)=H2O(l) △H3
O2(g)=H2O(l) △H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) 的△H=______________。
(3)H3AsO3 和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的依度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。

①以酚酞为指示剂(变色范围pH:8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为_______________。
②已知H3AsO4的各级电离常数为Ka1、Ka2、Ka3,则Ka2=_______________。
【答案】 制成浆状可以增加反应物接触面积,加快反应速率;加压通O2可以增大O2浓度,加快反应速率,提高砷酸的产率 2△H1-△H2-3△H3 OH-+H3AsO3===H2AsO3-+H2O 1.0×10-7
【解析】(1)制成浆状可以增加反应物接触面积,加快反应速率;加压通O2可以增大O2浓度,加快反应速率,提高砷酸的产率;(2)已知:①As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s) △H1 ,②2As(s)+O2(g)=As2O5(s) △H2,③H2(g)+
H2(g)+2O2(g)=H3AsO4(s) △H1 ,②2As(s)+O2(g)=As2O5(s) △H2,③H2(g)+ ![]() O2(g)=H2O(l) △H3,由盖斯定律可求出总反应的反应热,即2①-②-3③,则△H= 2△H1-△H2-3△H3;(3)①以酚酞为指示剂(变色范围pH:8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,由图分析可知,H3AsO3转化为H2AsO3-,该过程中主要反应的离子方程式为:OH-+H3AsO3===H2AsO3-+H2O。②已知H3AsO4的Ka2==
O2(g)=H2O(l) △H3,由盖斯定律可求出总反应的反应热,即2①-②-3③,则△H= 2△H1-△H2-3△H3;(3)①以酚酞为指示剂(变色范围pH:8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,由图分析可知,H3AsO3转化为H2AsO3-,该过程中主要反应的离子方程式为:OH-+H3AsO3===H2AsO3-+H2O。②已知H3AsO4的Ka2==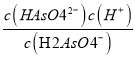 ,由图2分析可知,当pH=7时,c(H2AsO4-)=c(HAsO42-),所以,Ka2==1.0×10-7。
,由图2分析可知,当pH=7时,c(H2AsO4-)=c(HAsO42-),所以,Ka2==1.0×10-7。

【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝