题目内容
在密闭容器中加入等浓度的CO与H2O,T ℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH< 0
CO2(g)+H2(g) ΔH< 0
已知CO的浓度变化如图所示,第4 minCO的浓度不再改变。

(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min);该反应的平衡常数表达式为:K= ;可计算得该反应的平衡常数结果为:K= 。
(2)为了增大CO的转化率,可以采取的措施有 。
(3)若不改变反应温度和反应物中CO的起始浓度,使CO的转化率达到90%,则水蒸气的起始浓度至少为 mol/L?
CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH< 0
CO2(g)+H2(g) ΔH< 0已知CO的浓度变化如图所示,第4 minCO的浓度不再改变。

(1)从0~4 min,该反应的平均速率v(CO)= mol/(L·min);该反应的平衡常数表达式为:K= ;可计算得该反应的平衡常数结果为:K= 。
(2)为了增大CO的转化率,可以采取的措施有 。
| A.增大反应物中CO的浓度 |
| B.降低反应温度 |
| C.将密闭容器体积压缩至一半 |
| D.加入适宜的催化剂 |
(1)0.03 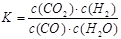 2.25 (2)B (3)0.90
2.25 (2)B (3)0.90
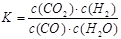 2.25 (2)B (3)0.90
2.25 (2)B (3)0.90 试题分析:(1)从0~4 min,v(CO)=(0.20mol·L-1-0.08 mol·L-1)÷4 min="0.03" mol/(L·min);
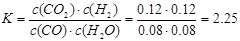 (2)增大反应物中CO的浓度,增大了H2O的转化率,但CO本身的转化率降低;降低反应温度,平衡右移,CO的转化率增大;将密闭容器体积压缩至一半,增大压强,平衡不移动,CO的转化率不变;加入适宜的催化剂,反应速率加快,平衡不移动,CO的转化率不变。(3)设水蒸气的起始浓度至少为x mol/L。当CO的转化率达到90%,则CO的转化浓度为0.18 mol/L,平衡时,CO(g)、H2O(g) 、CO2(g)和H2(g)的浓度分别为0.02 mol/L、(x-0.18)mol/L、0.18 mol/L、0.18 mol/L,代入平衡常数
(2)增大反应物中CO的浓度,增大了H2O的转化率,但CO本身的转化率降低;降低反应温度,平衡右移,CO的转化率增大;将密闭容器体积压缩至一半,增大压强,平衡不移动,CO的转化率不变;加入适宜的催化剂,反应速率加快,平衡不移动,CO的转化率不变。(3)设水蒸气的起始浓度至少为x mol/L。当CO的转化率达到90%,则CO的转化浓度为0.18 mol/L,平衡时,CO(g)、H2O(g) 、CO2(g)和H2(g)的浓度分别为0.02 mol/L、(x-0.18)mol/L、0.18 mol/L、0.18 mol/L,代入平衡常数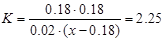 ,可求出x=0.90。
,可求出x=0.90。点评:化学反应速率和化学平衡常数是高考必考知识点,考生在备考过程中应注意积累掌握典型的题型。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1) N2O3(g) ΔH<0
N2O3(g) ΔH<0 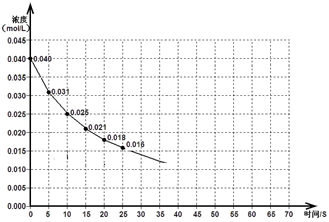
 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q Ni(S)+4CO(g)
Ni(S)+4CO(g)
 C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。?
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。? 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表: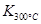 >
>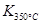 ,则该反应是 热反应。
,则该反应是 热反应。