题目内容
【题目】某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
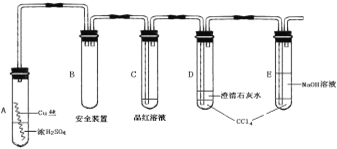
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录:
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S = Cu2S(黑色)。
材料二:探究实验剪辑
实验1 将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2 截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3 将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______________。
(2)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:_______________。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:______________。设计实验验证你的猜想_____________。
(5)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_______。(写化学式)
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 冷凝、回流 防止倒吸 S+2H2SO4(浓)
CuSO4+SO2↑+2H2O 冷凝、回流 防止倒吸 S+2H2SO4(浓)![]() 3SO2↑+2H2O 由于SO2溶解度较大,生成了Ca(HSO3)2溶液的缘故 取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可给分) CuO、CuS、Cu2S
3SO2↑+2H2O 由于SO2溶解度较大,生成了Ca(HSO3)2溶液的缘故 取样后,向其中加入氢氧化钠溶液,观察是否有沉淀生成。(或者加热、加盐酸检验SO2气体等方法,开放题,正确即可给分) CuO、CuS、Cu2S
【解析】
(1)金属铜与浓硫酸反应生成硫酸铜、二氧化硫和水,据此书写方程式;
(2)长导管除了导气作用之外,还可以让气体冷凝,回流;二氧化硫和强碱的反应十分剧烈,且易溶于水;
(3)硫在加热时能和浓硫酸反应生成二氧化硫和水,据此写出反应的化学方程式;
(4) SO2的溶解度较大,正盐可能转化为酸式盐,可以使用氢氧化钠溶液将酸式盐转化为正盐检验;
(5)根据实验1、实验2、实验3的现象以及定量实验的数据进行对比分析,可以确定黑色物质中有CuO、CuS、Cu2S。
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)根据实验装置,长导管的作用一定是能导气,但气体在导管中时间一长就会冷凝,回流;二氧化硫在强碱溶液中的溶解度很大,但其不溶于四氯化碳,故可以采用四氯化碳来防止倒吸现象的发生,故答案为:导气、冷凝、回流;防止倒吸;
(3)浓硫酸具有强氧化性,硫在加热时能和浓硫酸反应,反应的化学方程式为S+2H2SO4(浓) ![]() 3SO2↑+2H2O,故答案为:S+2H2SO4(浓)
3SO2↑+2H2O,故答案为:S+2H2SO4(浓) ![]() 3SO2↑+2H2O;
3SO2↑+2H2O;
(4) 对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,说明生成了二氧化硫,但始终未见D试管中澄清石灰水出现浑浊或沉淀,可能是SO2溶解度较大,与澄清石灰水反应生成了Ca(HSO3)2溶液;可以加入氢氧化钠溶液,观察是否有沉淀生成,故答案为:由于SO2溶解度较大,生成了Ca(HSO3)2溶液的缘故;取样后,向其中加氢氧化钠溶液,观察是否有沉淀生成;
(5)含有铜元素的黑色物质有:CuO、CuS、Cu2S,根据实验1、实验2、实验3的现象进行对比分析可知,液面上的铜丝上的黑色物质主要是不溶于稀硫酸的Cu2S,液面下的铜丝上的黑色物质一定包含可溶于稀硫酸的CuO和不溶于稀硫酸的硫化物(CuS和Cu2S至少有一种)。试管底部有黑色颗粒物质,将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗,除去了其中的CuO,蒸馏水洗、干燥后得到的硫化物放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。若此硫化物全部是Cu2S,其与氧气反应后生成CuO,固体质量不变;若硫化物全部是CuS,其与氧气充分反应后生成CuO,质量减少16.7%,因此不溶于稀硫酸的硫化物中既有Cu2S,又有CuS。综合以上的分析和计算,可以确定液面下方铜丝表面的黑色物质成分为CuO、CuS、Cu2S,故答案为:CuO、CuS、Cu2S。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案